 |
|
Перелік екзаменаційних питань
ПАКЕТ
ЕКЗАМЕНАЦІЙНИХ БІЛЕТІВ
дисципліни «Аналітична хімія»
Галузь знань: 0401 Природничі науки
Спеціальність: 5.04010602 «Прикладна екологія»
Миргород
Пакет екзаменаційних білетів дисципліни «Аналітична хімія»складено на основі Галузевого стандарту підготовки молодшого спеціаліста і навчального плану спеціальності: 5.04010602 «Прикладна екологія»
Укладач: ____________ В.В. Лупашко, викладач, спеціаліст вищої категорії
Пакет екзаменаційних білетів розглянуто і схвалено на засіданні циклової комісії екологічних дисциплін
Протокол № ______ від «___»______________20___ року
Голова циклової комісії _________ Л.В.Лестус
ЗАТВЕРДЖУЮ
Заступник директора
з навчальної роботи
_____________О.О. Тараненко
«____» ___________20 ___ року
Перелік екзаменаційних питань
дисципліни « Аналітична хімія»
Галузь знань 0401 «Природничі науки»
Спеціальність 5.04010602 « Прикладна екологія»
1. Характеристика аналітичної хімії, як науки. Її особливості і задачі.
2. Методи хімічного аналізу і їх класифікація.
3. Поняття: «розчини», «розчинення», «розчинність», «гомогенна і гетерогенна системи».
4. Поняття «концентрація розчину». Охарактеризувати види концентрацій розчину.
5. Швидкість хімічної реакції. Її залежність від умов навколишнього середовища.
6. Закон дії мас. Математичний вираз закону.
7. Поняття «оборотна» і «необоротна» реакції.
8. Сутність хімічної рівноваги і її залежності від зміни концентрації речовин, температури, тиску (для газів).
9. Поняття «константа хімічної рівноваги». Її залежність від температури.
10. Сутність теорії електролітичної дисоціації. Дисоціація кислот, основ і солей.
11. Характеристика константи дисоціації. Записати вираз константи дисоціації (К) для процесу: СН 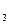 СООН
СООН  Н
Н  + СН
+ СН 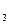 СОО
СОО  .
.
12. Макро-, мікро-, напівмікрометоди якісного аналізу.
13. Методи визначення рН середовища. Регулювання рН
14. Поняття «добуток розчинності (ДР)» речовини. Його вплив на результати аналізу.
15. Ненасичений», «насичений» і «пересичений» розчин.
16. Гідроліз солей. Типи та ступінь гідролізу.
17. Сутність реакцій окиснення - відновлення і їх роль у хімічному аналізі.
18. Підбір стехіометричних коефіцієнтів в ОВР методом електронного балансу. Навести приклад.
19. Комплексні сполуки. Будова і особливості комплексних сполук.
20. Систематичний хід якісного аналізу суміші катіонів. Приклади якісних реакцій.
21. Систематичний хід якісного аналізу суміші аніонів. Приклади якісних реакцій.
22. Гравіметричний метод аналізу. Його суть і особливості.
23. Кислотно - основний метод аналізу. Його суть і особливості.
24. Методи окиснення - відновлення. Їх суть і особливості.
25. Метод осадження. Його суть і особливості.
26. Комплексонометричний метод аналізу. Його суть і особливості.
27. Йонообмінна хроматографія. Її суть і особливості.
28. Візуальна колориметрія. Її суть і особливості.
29. Фотоколориметрія та спектрофотометрія. Суть і особливості методів.
30. Полуменева фотометрія. Її суть і особливості.
31. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук NH  Cl і КОН
Cl і КОН
32. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук МgCl2і NН4ОН.
33. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук МgSО  і КОН.
і КОН.
34. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук ВаCl2і (NH4)2СО 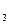 .
.
35. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук ВаCl2і К2СrО4.
36. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук ВаCl2і (NH4)2С2О4.
37. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук АlCl 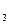 і NаОH.
і NаОH.
38. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук NаCl і АgNO 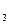 .
.
39. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук Nа2SO4і ВаCl2.
40. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук Nа2СО3і НCl.
41. Скласти в молекулярній та йонній формах рівняння реакції взаємодії розчинів сполук FеCl3і NаОН
42. Скласти в молекулярній і йонній формах рівняння гідролізу солі СН3СООNа.
43. Скласти в молекулярній і йонній формах рівняння гідролізу солі NН  Cl
Cl
44. Скласти в молекулярній і йонній формах рівняння гідролізу солі FеCl 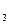 .
.
45. Скласти в молекулярній і йонній формах рівняння гідролізу солі АlCl 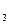 .
.
46. Чи гідролізує сіль КNО3? Дати пояснення навівши рівняння хімічного процесу.
47. Чи гідролізує сіль КCl? Дати пояснення навівши рівняння хімічного процесу.
48. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
КМnО4+ Nа2SO 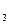 + Н2SО4= МnSO4+ Nа2SO4+ К2SO4+ Н2О
+ Н2SО4= МnSO4+ Nа2SO4+ К2SO4+ Н2О
49. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
КМnО4+ Nа2SO 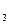 + КОН = К2МnО4+ Nа2SO4+ Н2О
+ КОН = К2МnО4+ Nа2SO4+ Н2О
50. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
К2Сr2О  + Nа2SO
+ Nа2SO 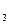 + Н2SО4= Сr2(SО4)3+ Nа2SO4+ К2SO4+ Н2О
+ Н2SО4= Сr2(SО4)3+ Nа2SO4+ К2SO4+ Н2О
51. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
К2СrО4+ Н2S + КОН = К3СrО3+ S + Н2О
52. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
Н2SО4+ НІ = І2+ Н2S + Н2О
53. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
Рb + НNO3= Рb(NO3)2+ NO2+ Н2О
54. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
Сu + НNO3= Сu (NO3)2+ NO+ Н2О
55. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
FеCl3+ Н2S = FеCl2+ S + НCl
56. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції::
FеSО4+ КМnО4+ Н2SО4= Fе2(SО4)3+ МnSО4+ К2SО4+ Н2О
57. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
Nа2С2О4+ КМnО4+ Н2SО4= СО2+ МnSО4+ К2SO4+ Nа2SO4+ Н2О
58. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти ОВ реакції:
Н2С2О4+ КМnО4+ Н2SО4= СО2+ МnSО4+ К2SO4+ Н2О
59. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
СrCl3+ Cl2+ КОН = К2СrО4+ КCl + Н2О
60. Скласти електронний баланс, вказати процеси окиснення і відновлення, урівняти рівняння ОВ реакції:
КМnО4+ Nа2SO3+ Н2О = МnO2+ Nа2SO4+ КОН
61. Визначити кількість цукру і води, яка необхідна для приготування 750 г 20%-го розчину цукру.
62. Визначити кількість води, яку потрібно випарити із 6 л 8% - го розчину К2SO3( 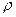 =1,067), щоб отримати розчин, в якому концентрація К2SO3 складає 51,6%.
=1,067), щоб отримати розчин, в якому концентрація К2SO3 складає 51,6%.
63. Візуальною колориметрією, за допомогою колориметра Дюбоска, було проведено визначення вмісту купруму в досліджуваному розчині. Дані дослідження: С( станд.) - 2,0 мг/мл; h( станд.) - 12 мм; h( досл.) - 15 м.
64. Твердість води визначають комплексонометричним методом. Скласти формулу і визначити загальну твердість води Х (мг.-екв/л) використовуючи такі дослідні дані: N (Тr.Б) – 0,1 г.-екв/л; V (Тr.Б) – 20 мл; 1000 – перерахунок з мілілітрів на літри; V (Н2О) – 100 мл.
65. Обчислити нормальність розчину кислоти НСl, густина ( 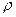 ) якої дорівнює 1,1 г/см
) якої дорівнює 1,1 г/см  .
.
66. Обчислити нормальність розчину кислоти НNО3, густина ( 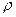 ) якої дорівнює 1,245 г/см
) якої дорівнює 1,245 г/см  .
.
67. Визначити молярність 2,37%-го розчину КМnО4( 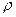 =1 г/см
=1 г/см  ).
).
68. Визначити молярність 3,15%-го розчину КМnО4( 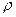 =1 г/см
=1 г/см  ).
).
69. Обчислити молярність 62%-ої сульфатної кислоти, якщо густина її становить ( 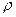 =1,520 г/см
=1,520 г/см  ).
).
70. У 80 г води розчинено 4 г солі. Визначити вміст і розчинність цієї солі.
71. Визначити кількість води, яку потрібно випарити із 6 л 8% - го розчину К2SO3( 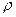 =1,067), щоб отримати розчин, в якому концентрація К2SO3складає 51,6%.
=1,067), щоб отримати розчин, в якому концентрація К2SO3складає 51,6%.
72. У 65 г води розчинено 3,5 г солі. Визначити вміст і розчинність цієї солі.
73. Визначте рН розчину, одержаного при розчиненні 1,12л HCI в 500мл води за нормальних умов.
74. Розрахуйте рН розчину, отриманого при розведенні 50мл 40,2%-го розчину етанової кислоти водою до 1000мл. ρ=1,05г/мл. КД,Нас=1,74∙10-5.
75. Визначте розчинність ферум (ІІІ) гідроксиду і концентрацію йонів Fe3+ (г/л) в насиченому розчині.  .
.
76. Визначити масову частку барію в зразку кристалічного хлориду барію ВаСl2∙ 2Н2О.
77. Визначити масову частку кристалізаційної води в кристалічному хлориді барію ВаСl2∙2Н2О, якщо маса ВаСl2∙ 2Н2О дорівнює 2,6903г, а маса води дорівнює 0,3980 г.
78. Визначити, скільки грамів хлороводню (НСl) міститься в 200 мл 0,1 н розчину.
79. Визначити, скільки грамів сульфатної кислоти (Н 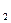 SО
SО  ) міститься в 250 мл 0,1 н розчину
) міститься в 250 мл 0,1 н розчину
80. Визначити, скільки грамів нітратної кислоти (НNО 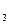 ) міститься в 300 мл 0,2 н розчину.
) міститься в 300 мл 0,2 н розчину.
81. В 10 мл розчину міститься 4 мг НNО 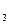 . Обчислити нормальність розчину.
. Обчислити нормальність розчину.
82. Визначити титр розчину КОН, якщо в 250 мл його міститься 1,4 г їдкого калію.
83. Визначити титр розчину лугу, якщо в 300 мл його міститься 2,3 г NаОН.
84. Визначити титр 0,2 н розчину Н2SО4.
85. Визначити титр 0,1 н розчину НNО 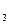 .
.
86. У 200 мл розчину соди Nа 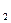 СО
СО 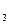 міститься 2,14 г солі. Визначити титр і нормальність розчину.
міститься 2,14 г солі. Визначити титр і нормальність розчину.
87. У 250 мл розчину лугу міститься 2,805 г КОН. Визначити титр і нормальність розчину.
88. Визначити титр і нормальність розчину кислоти, якщо в 300 мл його міститься 1,89 г НNО 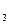 .
.
89. Визначити, скільки грамів КОН потрібно взяти для приготування літрів 2 н. розчину.
90.Визначити, скільки грамів NаОН потрібно взяти для приготування 3 літрів 0,1 н. розчину.
Укладач: ____________ В.В. Лупашко, викладач, спеціаліст вищої категорії
Протокол № ______ від «___»______________20___ року.
Голова циклової комісії _________ Л.В. Лестус
Форма № Н-5.05
Миргородський художньо-промисловий коледж імені М. В. Гоголя
Полтавського національного технічного університету імені Юрія Кондратюка
Освітньо-кваліфікаційний рівень: молодший спеціаліст
Спеціальність 5.04010602 «Прикладна екологія» Семестр 4
Навчальна дисципліна «АНАЛІТИЧНА ХІМІЯ»