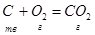|
|
Параметры состояния
ЛЕКЦИЯ №8.
Закономерности протекания химических реакций
Введение в термодинамику. Понятие об энтропии, энтальпии, энергии Гиббса. Возможность протекания химических реакций. Энтальпийный и энтропийный факторы процессов.
Химическая термодинамика
Вопрос возможна ли в принципе та или иная самопроизвольная реакция в тех или иных условиях, рассматривает химическая термодинамика. Например, взрыв пороха (селитры, серы и угля) не возможен сам по себе. При обычных условиях реакция не идёт. Для её начала необходимо t°, либо удар.
Химическая термодинамика рассматривает переход системы из одного состояния в другое, полностью игнорируя механизм перехода. О том, как совершается переход исходных веществ в продукты реакции и как зависит скорость от условий реакции рассматривает химическая кинетика. Если термодинамически реакция запрещена, то бессмысленно рассматривать её скорость, эта реакция самопроизвольно не протекает.
Если же реакция термодинамически возможна, то скорость можно изменить, например, введя катализатор. Теории, законы, численные характеристики, необходимы для того, чтобы управлять реакциями: замедлить процессы коррозии металлов или составить композицию ракетного топлива и т.д.
Термодинамика – наука о превращениях одних видов энергии и работы в другие. Существуют 3 начала термодинамики.
Химической называется термодинамика рассматривающая превращение энергии и работы при химических реакциях. Для этого необходимо знать функцию состояния.
Функцией состояния называется такая переменная характеристика системы, которая не зависит от предыстории системы и изменение которой при переходе системы из одного состояния в другое не зависит от того, каким образом было произведено это изменение.
 | |||
| |||
Чтобы можно было пользоваться функциями состояния, необходимо обозначить сами состояния.
Параметры состояния
| Р- давление |  ; ;
|
| V – объем | часть пространства, занимаемая системой. |
| ν – число молей |  ; ;  ; ;
|
| Т – температура |  , для идеального газа,
Т = 273,16 К для тройной точки воды. , для идеального газа,
Т = 273,16 К для тройной точки воды.
|
| Т˚ - стандартная t˚ | Т˚ = 25˚С = 298,16 К |
| Р˚ - стандартное Р | Р˚ = 1 атм = 760 мм рт.ст. = 101,3 кПа |
Функции состояния
| U – внутренняя энергия | 
|
| Н – энтальпия | 
|
| S – энтропия | 
|
| G – энергия Гиббса | 
|
A и Q, т.е. работа и теплота – это две функции, которым посвящена термодинамика, но которые не являются функциями состояния.
Любая система, переход которой из одного состояния в другое рассматривает термодинамика, может иметь:
I постоянный объем (т.е. например, запаянная ампула), V – const.
Процессы, протекающие при постоянном объеме, называются изохорическими, (изохорными).
II постоянное давление. изобарические процессы (изобарные), P – const.
III постоянная t˚. изотермические процессы, T – const.
Процессы, протекающие в системе в условиях, когда отсутствует обмен теплотой между системой и внешней средой, называются адиабатическими.
Теплота, полученная системой, считается положительной, а отданная системой во внешнюю среду – отрицательной. Теплота определяется числом Дж (кДж).
Первое начало термодинамики. Энтальпия.
I закон термодинамики – закон сохранения и превращения энергии.
 , т.е.
, т.е.
изменение внутренней энергии системы равно разности между количеством теплоты, полученной системой из среды, и количеством работы, произведенной системой над средой.
ΔU – в химической реакции – это изменение внутренней энергии системы в результате превращения определенного числа молей исходных веществ в определенное число молей продуктов реакции.
 (разность между энергиями конечных и начальных состояний).
(разность между энергиями конечных и начальных состояний).
 тогда
тогда 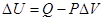
Если реакция изохорная, то V-const и  (т.е. количеству теплоты, полученное или отданное системой).
(т.е. количеству теплоты, полученное или отданное системой).
Если же реакция изобарная, то она проходит при постоянном внешнем давлении:
 тогда
тогда 
Большинство химических реакций проходит в изобарных условиях, т.е. необходимо определить QP и работу расширения (сжатия).
Для упрощения ситуации в термодинамике принята новая функция – энтальпия Н.

Изменение энтальпии в реакции будет равно:

Учитывая уравнение (1), получим
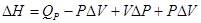 .
.

а поскольку реакция идет в изобарных условиях, то P = const  .
.
 , но мы знаем, что
, но мы знаем, что  , подставим:
, подставим:

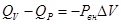

 , тогда
, тогда
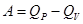 , т.е. разность между тепловыми эффектами одной и той же реакции, измеренными при постоянном давлении и постоянном объеме, равна работе расширения. Таким образом, изменение энтальпии однозначно связано с количеством теплоты, полученной или отданной системой при изобарном переходе, а изменение энтальпии ΔН обычно принимают за меру теплового эффекта химической реакции.
, т.е. разность между тепловыми эффектами одной и той же реакции, измеренными при постоянном давлении и постоянном объеме, равна работе расширения. Таким образом, изменение энтальпии однозначно связано с количеством теплоты, полученной или отданной системой при изобарном переходе, а изменение энтальпии ΔН обычно принимают за меру теплового эффекта химической реакции.
Тепло костра, прокаливание известняка, фотосинтез растений, электролиз – это примеры обмена различными формами энергии.
Тепловым эффектом химической реакции называется изменение энергии при изобарном переходе определенного числа молей исходных веществ в соответствующее число молей продуктов реакции (в Дж или кДж).
Измеряется изменением энтальпии при переходе системы из состояния исходных веществ в продукты реакции. При этом сохраняется термин экзо и эндотермической реакции. Измеряется калориметром. Тепловые эффекты реакций, протекающих в прямом и обратном направлении, равны по величине и противоположны по знаку.
Н2 + Cl2 = 2HCl ΔН = – 184 кДж
2HCl = H2 + Cl2 ΔН = + 184 кДж
Фундаментальный закон термохимии был сформулирован Гессом в 1840г.
 Тепловой эффект реакции зависит только от состояния исходных и конечных веществ и не зависит от числа промежуточных стадий.
Тепловой эффект реакции зависит только от состояния исходных и конечных веществ и не зависит от числа промежуточных стадий.
Для получения 1 моля СО2 необходимо 1 моль С (тв) и 1 моль О2 (г).
Суммируя стадии и энтальпии всех стадий находим, что:

Этот процесс называется циклом. Для того, чтобы рассчитать тепловой эффект реакции необходимо знать энтальпии разложения исходных веществ и энтальпии образования продуктов реакции из простых веществ. Но они равны по величине и различны по знаку, поэтому достаточно знать одну энтальпию. Т.к. энтальпия зависит от его состояния и от условий, то все состояния и условия отнесены к одинаковым, которые называются стандартными.
t˚ = 25˚С, Р = 101,3 кПа
t˚ эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ.

 .
.
Переход из стандартного состояния в любое другое сопровождается увеличением энтальпии, т.е. эндотермическим тепловым эффектом.
 простых веществ равны нулю.
простых веществ равны нулю.
 - называется стандартной энтальпией (теплотой образования).
- называется стандартной энтальпией (теплотой образования).
(˚) – означает, что все вещества находятся в стандартных состояниях.
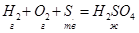

Энтальпией образования сложного вещества из простых веществ называется тепловой эффект реакции образования данного вещества из простых веществ в стандартных состояниях, отнесенный к 1 молю получающегося вещества.  . (f – formation – образование).
. (f – formation – образование).
Энтропия
Энтропия (S) пропорциональна логарифму термодинамической вероятности (W) состояния системы.
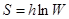 , h – постоянная Больцмана
, h – постоянная Больцмана
Энтропия – есть мера неупорядоченности системы. Энтпропия вводится как функция состояния, изменение которой определяется отношением количества теплоты, полученное или отданное системой при t – T.

Если система получает некоторое количество теплоты при постоянной t˚, то вся теплота идёт на увеличение беспорядочного, хаотического движения частиц, т.е. увеличения энтропии.
II Второе начало термодинамики
Второе начало термодинамики утверждает, что в изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к увеличению энтропии (неупорядоченная система).
Испарение эфира с руки протекает самопроизвольно с увеличением энтропии, но теплота для такого перехода отнимается от руки, т.е. процесс идёт эндотермически.
III Третье начало термодинамики
Энтропия идеального кристалла при абсолютном нуле равна нулю. Это третье начало термодинамики.
S˚298 – стандартная энтропия, Дж/(к·моль).
Если ΔН велико, то ΔS мало. Но это не всегда так. Гиббс ввел в термодинамику новую функцию состояния – энергию Гиббса – G.
G = H – TS или ΔG = ΔH – TΔS
В любой закрытой системе при постоянных Р и Т возможен такой самопроизвольный процесс, который ведет к уменьшению энергии Гиббса ΔG < 0.
Если T → 0, то ΔG → ΔH
Таким образом, при низких t˚ величина и знак ΔG определяется величиной и знаком ΔН. При низких t˚ самопроизвольно протекают экзотермические реакции, при высоких определяется величиной ΔS, т.е. самопроизвольно идут реакции с увеличением энтропии.
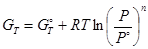 – уравнение для идеального газа.
– уравнение для идеального газа.
n – моли
Р˚ - 101,3 кПа
 – уравнение для растворов
– уравнение для растворов
с˚ = 1моль/л.
Например: