|
|
Работа при изменении объема газа
Инженерный метод определения количества теплоты, подведённой (отведённой) в процессе.??
1. ds>0, след. dq>0; 2. ds<0, след. dq<0
q1-2=∫(от s1 до S2)T ds. Для того, чтобы взять инт.нужно знать, что Т=Т(S). Площадь=кол-ву теплоты. Количество теплоты, участв. в процессе зависит от пути перехода системы из нач. положения в конечное
Теплоёмкость – кол-во теплоты, кот. необходимо передать телу для того, чтобы повысить его температуру на 1 град С
Виды: массовая С и объемная С’, молярная Cr. Для газов: изохорнаяCv и изобарнаяCp.
Телоёмкость в-ва зависит от температуры, с ростом температуры она увеличивается.
Работа при изменении объема газа
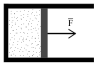 Газ оказывает давление на любую стенку сосуда. Если стенка подвижна (например, поршень на рис. 1), то сила давления F совершит работу A, переместив поршень на расстояние DL.
Газ оказывает давление на любую стенку сосуда. Если стенка подвижна (например, поршень на рис. 1), то сила давления F совершит работу A, переместив поршень на расстояние DL.
Если DL невелико, то давление газа останется примерно постоянным. Тогда работа будет равна:
A = F·DL·cosa = P·S·DL,
где S - площадь поршня,
a - угол между направлением силы и перемещением поршня (a = 0).
Произведение S·DL равно изменению объема газа DV от начального V1 до конечного V2 значения, т.е. S·DL =DV = V1 - V2. Тогда
A = P·(V2 - V1) = P·DV.
В изобарном процессе расширения газа P = const. Следовательно, при любом сколь угодно большом увеличении объема сила давления газа на поршень будет постоянной, и формула работы сохранит свой вид
A = P·(V2 - V1).
Как видно из рисунка 2, работа газа при изобарном расширении равна площади под графиком процесс

7. Сформулируйте первый закон термодинамики и приведите его математическое выражение. Изменение внутренней энергии системы равно сумме внешних энергетических воздействий на неё.
Мат.выражение: изменение удельной внутренней энергии термодинамической системыравно алгебраической сумме полученной системой энергии в форме удельной теплоты δq и совершенной ею внешней удельной работой δl, или подведенная к рабочему телу энергия в форме удельной теплоты расходуется на изменение удельной внутренней энергии тела и на совершение телом внешней работы.
Изопроцессы
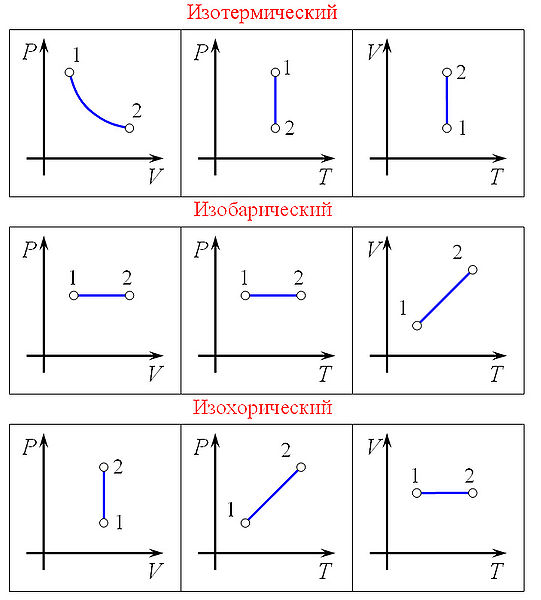
Графики изопроцессов в различных системах координат
Изобарный процесс (др.-греч. ισος, isos — «одинаковый» + βαρος, baros — «вес») — процесс изменения состояния термодинамической системы при постоянном давлении (P = const).
Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована в 1862 году Жозефом Луи Гей-Люссаком.
[править]
Изохорный процесс (от греч. хора — занимаемое место) — процесс изменения состояния термодинамической системы при постоянном объёме (V = const). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объеме, давление прямо пропорционально температуре:
Линия, изображающая изохорный процесс на диаграмме, называется изохорой.
ещё стоит указать что поданная к газу энергия расходуется на изменение внутренней энергии то есть Q = 3* ν*R*T/2=3*V*ΔP, где R - универсальная газовая постоянная, ν количество молей в газе, T теплота в Кельвинах, V обьём газа, ΔP приращение изменения давления. а линию, изображающая изохорный процесс на диаграмме, в осях Р(Т), стоит продлить и пунктиром соединить с началом координат, так как может возникнуть недопонимание.
[править]
Изотермический процесс (от греч. «термос» — тёплый, горячий) — процесс изменения состояния термодинамической системы при постоянной температуре (T = const). Изотермический процесс описывается законом Бойля — Мариотта:
PV = const
Адиабатический процесс — процесс изменения состояния термодинамической системы при постоянной энтропии (S = const). В таком процессе не происходит теплообмена газа с окружающей средой. Газ в этом процессе описывается следующим уравнением:
pVγ = const, где γ — показатель адиабаты, определяемый типом газа.