 |
|
Какой объем оксида серы(IV) (н.у.) потребуется для полного обесцвечивания раствора перманганата калия объемом 250 мл, если его концентрация эквивалента равна 0,1 моль/л?
Какие свойства (окислительные или восстановительные) проявляет сернистая кислота при её взаимодействии: а) с магнием; б) с йодной водой; в) с водным раствором сероводорода? Напишите уравнения указанных реакции.
Решение:
а) При взаимодействии с магнием сернистая кислота проявляет окислительные свойства за счёт атома водорода:
Mg + H2SO3 = MgSO3 + H2

 восстановитель Mg0 - 2ē → Mg2+ 1
восстановитель Mg0 - 2ē → Mg2+ 1
окислитель 2H+ + 2ē → H20 1
б) При взаимодействии с йодной водой сернистая кислота проявляет восстановительные свойства за счёт атома серы:
H2SO3 + I2 + H2O = H2SO4 + 2HI

 восстановитель S+4 - 2ē → S+6 1
восстановитель S+4 - 2ē → S+6 1
окислитель I20 + 2ē → 2I- 1
в) При взаимодействии с раствором сероводорода сернистая кислота проявляет окислительные свойства за счёт атома серы:

 H2SO3 + 2 H2S = 3S↓ + H2O
H2SO3 + 2 H2S = 3S↓ + H2O
восстановитель S-2 - 2ē → S0 2
окислитель S+4 + 4ē→S0 1
Испытание на подлинность нитрита натрия, применяемого как сосудорасширяющее средство, проводят одним из следующих способов: а) к нитриту натрия прибавляют разбавленную серную кислоту, выделяются бурые пары; б) к нескольким каплям препарата добавляют по каплям раствор йода калия и разведенной соляной кислоты: жидкость окрашивается в желтый цвет. Напишите уравнения протекающих реакции. Какова роль нитрит-иона в этих реакциях?
Решение:
а) 2NaNO2 + H2SO4 = NO2↑+ NO↑ + Na2SO4 + H2O
«бурый газ»

 восстановитель N+3 - 1ē → N+4 1
восстановитель N+3 - 1ē → N+4 1
окислитель N+3 +1ē → N+2 1
Данная реакция относится к реакциям диспропорционирования, т.к. атом азота в нитрит-ионе является и окислителем, и восстановителем.
б) NaNO2+ 2KI + 2HCl = I2 + NO + KC l + NaCl + H2O

 восстановитель 2I- - 2ē → I20 1
восстановитель 2I- - 2ē → I20 1
окислитель N+3 +1ē → N+2 2
В данной реакции нитрит-ион выполняет роль окислителя.
Составьте уравнения реакции, в которых соединения N(III) проявляют: а) окислительные; б) восстановительные свойства.
Решение:
Рассмотрим уравнения реакций для нитрит-иона NO2-:
а)  2NaNO2 + 2KBr+ 2H2SO4 = Br2 + 2NO + K2SO4 + Na2SO4 + 2H2O
2NaNO2 + 2KBr+ 2H2SO4 = Br2 + 2NO + K2SO4 + Na2SO4 + 2H2O

 восстановитель 2Br- - 2ē → Br20 1
восстановитель 2Br- - 2ē → Br20 1
окислитель N+3 +1ē→ N+2 2
б) 
 2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
восстановитель N+3 - 2ē→ N+5 5
окислитель Mn+7 + 5ē→ Mn+2 2
Какой объем оксида серы(IV) (н.у.) потребуется для полного обесцвечивания раствора перманганата калия объемом 250 мл, если его концентрация эквивалента равна 0,1 моль/л?
Решение:
Запишем уравнение реакции:
2KMnO4+5SO2+ 2H2O = 2MnSO4 + 2H2SO4 + K2SO4
Рассчитаем количество вещества перманганата калия в растворе, исходя из его эквивалентной концентрации:
n(KMnO4)= CN(KMnO4)∙V(KMnO4)
n(KMnO4) = 0,1 моль/л∙0,25 л = 0,025 моль.
Cоставим пропорцию:
2 моль KMnO4 реагирует с 5 моль SO2
0,025 моль KMnO4 реагирует с х моль SO2
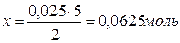
Следовательно, n(SO2) = 0,0625 моль.
Найдем объем оксида серы (IV)через молярный объем:
V(SO2)=n(SO2)∙VМ = 0,0625 моль∙22,4 л/моль = 1,4л.
Ответ: V(SO2) = 1,4 л
Список используемой литературы
1. Ахметов Н.С., Общая и неорганическая химия, М.:Высшая школа, 2008 – 742с.
2. Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. Ю.А.Ершов, В.А.Попков, А.С.Берлянд и др., 8 изд., - М.: Высш.шк., 2010. - 560 с.
3. Сборник задач и упражнений по общей химии. Учебное пособие. С.А. Пузаков, В.А. Попков, А.А. Филиппова. М. : Высшая школа., 4 изд. 2010. - 255 с.