 |
|
Електрохімічні методи аналізу, їх теоретичні основи та класифікація.
Задача.
Привести потенціометричне титрування V(х) = 20,00 мл = 0,020 л
аналізуючого розчину кислоти стандартним розчином гідроксиду натрію з концентрацією С(N2OH) = 0,1000 моль/л та отримати слідуючи результати (V(Т) – об‘єм прибавляючого титранта.)
| V(T), мл | 18,00 | 19,00 | 19,50 | 19,90 | 70,00 | 20,10 | 20,50 | 21,00 |
| рН | 5,71 | 6,04 | 6,35 | 7,05 | 8,79 | 10,52 | 11,22 | 11,21 |
Знайти полярну концентрацію та вагу оцтової кислоти в аналізуємому розчині з використанням розрахункового способу.
Розв‘язування:
1) по отриманим при титруванні даним розраховуємо необхідну величину представимо, іх, як і у попередньому прикладі, у вигляді таблиці.
| V1, мл | рН | РН | V, м2 | ЕІ V | DЕ( V)=А |
| 18,00 | 5,71 | 0,33 0,31 0,70 1,74 1,73 0,70 0,29 | 1,00 0,50 0,40 0,10 1,10 0,40 0,29 | 0,33 0,62 1,75 17,40 17,30 1,75 0,58 | 0,29 1,13 15,65 -0,10 -15,55 -1,17 |
| 19,00 | 6,04 | ||||
| 19,50 | 6,35 | ||||
| 19,90 | 7,05 | ||||
| 20,00 | 8,79 | ||||
| 20,70 | 10,52 | ||||
| 20,50 | 11,22 | ||||
| 21,00 | 11,51 |
2) Розрахуємо по формулі (10,18) об‘єм титранту V(TЭ), прибавлений в ТЭ, скористувавшись даними таблиці:
V(T) = V1+(V2-V1)A1/А1-А2 = 19,90+(20,00-19,90) 15,65/(15,65-(-0,1))
= 20,00 мл;
3) Визначаємо молярну концентрацію С(х) та вагу m(х) оцтової кислоти у аналізую чому розчині:
С(х) =  =
= 
 = 0,1000 моль/л;
= 0,1000 моль/л;
m(х) = C(х)m(х)V(х) = 0,1000 60,052 0,020 m= 0,1201 г, де m(х) = 60,052 – молярна вага оцтової кислоти.
ЕТАЛОННА ВІДПОВІДЬ
Варіант №2
Електрохімічні методи аналізу, їх теоретичні основи та класифікація.
Електрохімічні методи аналізу (ЕМА) засновані на процесах, протікають на електродах або у міжелектродному просторі. ЕМА є одними з найстаріших ФХМА (деякими описані в кінці 19 століття). Їх перевагою є висока точність і порівняльна легкість. Висока точність вимірюється дуже точними використовуваними в ЕМА, наприклад, закон Фарадея. Великою зручністю є те, що в ЕМА використовують електричний вплив, і те, що результат цього впливу (відгук) теж виходить у вигляді електричного сигналу. Це забезпечує високу швидкість і точність відліку. Відкриває широкі можливості для автоматизації. ЕМА відрізняються гарною чутливістю та селективністю. Інструментом для ЕМА служить електрохімічний осередок. Це ємкість з розчином електроліту, який занурений як мінімум два електроди. Якщо аналітична окислювально-відновна реакція протікає на електродах без докладання напруги від зовнішнього джерела, а тільки за рахунок різниці потенціалів (ЕРС) її електродів, то такий осередок називають гальванічним елементом.
2. Сутність колориметричного методу аналізу. Що таке координати кольору. Застосування спектрофотометрів, фотоколориметрів.
Колориметрія - наука про кольори і виміри кольору. Це наука, що досліджує методи вимірювання, вираз кількості кольору і відмінностей кольорів, що виникла в XIX столітті. Виміряти колір - значить виразити його через якість величини і тим самим визначити його місце в рамках деякої системи їх вираження. При вимірі кольору основним завданням є визначення координат кольору, так як всі інші величини обчислюються за їх значенням. Координати кольору можуть бути або визначені безпосередньо за допомогою триколірних колориметрів або компараторів кольору, або обчислені на підставі спектрів дифузного відбиття або пропускання.
При падінні потоку випромінювання на поверхню предмета частина потоку може пройти крізь предмет, частина - відбитися від поверхні, а частина - поглинутися. Відношення відображеної, пропущеної і поглиненої частин потоку випромінювання до всього потоку, падаючого на предмет, називають, відповідно, коефіцієнтом відображення, пропускання і поглинання.
Для вимірювання коефіцієнтів відбиття і пропускання використовуються спектрофотометри. Колориметрія (від лат. color - Колір і греч. μετρεω - Вимірюю) - метод хімічного аналізу, заснований на визначенні концентрації речовини по інтенсивності забарвлення розчинів (більш точно - з поглинання світла розчинами).
Визначають інтенсивність забарвлення або візуально, або за допомогою приладів, наприклад колориметрів.
Більш досконалі прилади - спектрофотометри - відрізняються можливістю дослідження оптичної щільності в широкому діапазоні довжин хвиль видимого спектра, а також у ІК і УФ -діапазонах.
Фотоколориметри - кількісне визначення концентрації речовини з поглинання світла у видимій та ближній ультрафіолетовій області спектра. Поглинання світла вимірюють на фотоелектричних колориметра.
3. Задача.
Питома і еквівалентна електропровідність водного розчину оцтової кислоти при 250С порівняна відносно К=5,75 10-5 см см-1 і l=42,215 см см2 моль-1. Визначити концентрацію оцтової кислоти у розчині.
Рішення:
У відповідності з рівнянням можливо написати:
С=  ;
;
С=  =1,362×10-3моль/л
=1,362×10-3моль/л
ЕТАЛОННА ВІДПОВІДЬ
Варіант №3
1. Що представляє собою вольтамперометрія.
Вольтамперометрія — електрохімічний метод якісного та кількісного аналізу, який ґрунтується на реєстрації вольт-амперних кривих (вольтамперограм) — залежності між силою струму І у колі електролізера і напругою поляризації Е при електролізі розчину або розплаву досліджуваної речовини. У розчин занурюють індикаторний мікроелектрод, на якому досліджувана електрохімічно активна (електроактивна) речовина — деполяризатор відновлюється чи окислюється, і неполяризований допоміжний електрод, потенціал якого залишається практично незмінним при електролізі. Зміна потенціалу мікроелектрода під дією прикладеної напруги спричиняє виникнення струму у колі. Потенціал мікроелектрода відносно допоміжного електрода менший за Е на величину омічного спаду напруги у розчині ІR, де R — електричний опір розчину. З метою зменшення R до розчину додають надлишок індиферентного електроліту (фонового), іони якого не відновлюються і не окислюються в умовах електролізу. Фоновий електроліт також дозволяє усунути міграційний струм, який виникає за рахунок міграції частинок деполяризатора під дією електричного поля.
Як індикаторні мікроелектроди використовують крапельні (крапаючі) ртутні (або амальгамні) електроди, стаціонарні й обертальні металічні (ртутна крапля, срібло, золото, платина тощо), а також вугільні електроди. В. із крапельними металічними електродами називають полярографією (метод заснований чеським ученим Ярославом Гейровським у 1922 р.). Вольтамперограми реєструють за допомогою спеціальних приладів — полярографів. Вольтамперограми, одержані з крапельними ртутними (полярограми) або обертальними електродами для повністю оборотних систем, мають вигляд S-подібних хвиль, фактично еквівалентних кривим потенціометричного титрування. Така форма зумовлена тим, що при поступовій зміні ц струм І, що проходить через систему, спочатку зростає, а згодом набуває постійного значення, при якому практично всі частинки електроактивної речовини, що дифундують до поверхні електрода, реагують на електроді. Це значення сили струму залежить лише від швидкості процесу перенесення речовини за рахунок дифузії з об’єму розчину до поверхні електрода і називається граничним дифузійним струмом Ігр. У разі крапельного ртутного електрода залежність середнього значення Ігр від концентрації С0 визначається рівнянням Ільковича:
Ігр = К nF С0D1/2m2/3t1/6,
де n — кількість електронів, які беруть участь у реакції; F — число Фарадея; D — коефіцієнт дифузії реагуючих частинок; m — швидкість витікання ртуті з капіляра; t — час життя краплі; К — коефіцієнт пропорційності. Різні деполяризатори ідентифікуються за характерними для них значеннями так званих потенціалів півхвиль, тобто потенціалів, при яких І = ½Ігр. Вольтамперограми, зняті зі стаціонарними мікроелектродами, мають форму піків, низхідні ділянки яких визначаються збідненням приелектродного шару розчину деполяризатора.
Нижня межа концентрації Сн досліджуваної речовини, що визначається, яка може досягатися звичайними методами В., становить 10–5–10–6 М і обмежується значенням залишкового струму, який складається зі струму зарядження подвійного електричного шару біля поверхні мікроелектрода та струму, спричиненого перебігом електрохімічних реакцій домішок, присутніх у фоновому розчині. Зниження Сн до 10–7–10–8 М можливе при використанні удосконалених інструментальних варіантів —змінно струмової та диференціальної імпульсної В., при яких напруга поляризації змінюється і має, крім постійної, змінну, або імпульсну, складову. У цих варіантах реєструють залежність змінної складової І від Е або ϕ з такою фазовою або часовою селекцією, при якій внесок струму зарядження у вимірюваний аналітичний сигнал мінімальний. Ці залежності мають вигляд другої або наступних похідних звичайної полярографічної хвилі, що сприяє збільшенню роздільної здатності В. Для усіх варіантів В. можливий також методичний спосіб зниження Сн, що базується на попередньому електрохімічному чи хімічному концентруванні визначуваної речовини на поверхні або в об’ємі стаціонарного мікроелектрода з наступною реєстрацією так званої інверсійної вольтамперограми. Останню зі стаціонарним ртутним (на краплині) мікроелектродом називають також амальгамною полярографією із нагромадженням. В інверсійних варіантах вольтамперографії значення Сн досягає 10–9–10–11 М.
Вольтамперометрію застосовують для якісного і кількісного аналізу різноманітних речовин, у т.ч. лікарських, у дуже широкому діапазоні вмістів, що визначаються, — від 10–7 до десятків відсотків. За допомогою В. досліджують кінетику і механізм електродних процесів, які складаються зі стадій переносу електронів з наступними чи попередніми хімічними реакціями, будову подвійного електричного шару, комплексоутворення в розчинах, дисоціацію та утворення інтерметалічних сполук на ртутних і на поверхні твердих електродів. Напр., методом полярографії вперше був досліджений процес гідролізу пеніцилінів і встановлена природа продуктів їх гідролізу. Зараз В. — один із основних методів, які широко використовують у хіміко-токсикологічному аналізі отрут.
2. Дати зрівняльну характеристику призми і дифракційній решітці.
Головною частиною усякого спектрального пристрою є оптичний пристрій, який розподіляє на його складові частини, перетворюючи його у спектр.
У одному випадку світло розлягається кривою в наслідок показників приломлення для променів різної довжини. У другому – дисперсія відбувається при проходженні через дифракційну решітку, в наслідок фракції світла у більшій частині паралельності вузьких щілок.
Для виготовлення призми потрібна речовина з великою дисперсією оцінок при виборі матеріалу потрібна його прозорість. Для ультрафіолетових променів застосовуються флюорит CrF2.
Дифракційні решітки прозорі, відбиваючі виготовляють шляхом нанесення тонких штрихів загостренням алмаза, на.
Відбиваючі решітки виготовляють подібним нанесенням штрихів, але на плоских чи алюмінієвих дзеркалах наноситься 200-1200 пунктир 1 мм.
Світло -сила у дифракційних спектрографів більша ніж у приземних. Кут відхилення залежить від довжини хвилі.
3.Задача. Розрахувати умовний реальний потенціал електрода ІІ роду каманельного електрода Hq/Hq2Cl2×KCl при температурі Т = 298 К, якщо концентрація С(KCl)=0,1 моль/л коефіцієнт активності хлорид іонів G(Cl2)=0,755, стандартний потенціал канамельного електрода Ео=0,2682 В.Рішення: Для двох еталонних водних розчинів хлориду кальцію з вмістом хлориду кальцію Х=2,40 % і Х2=4,00 %, знайдено значення показника приломлення, які дорівнюють n=1,3360 і n2=1?3380, відповідно, а для аналізує мого розчину з вмістом хлориду кальцію Х-значення, n=1,3370.
У розглянутому інтервалі зміни вмісту хлориду кальцію зберігається лінійчата залежність між n і х.
Розрахувати вміст хлориду кальцію (х) у відсотках в аналізуємо му розчині, якщо:
а) від‘ємний показник переломлення розчинювала чистої води, n=1,3330;
б) показник переломлення чистої води невідомий.
Розв‘язок:
а) за формулою розраховую значення фактору (F):
F=n2-n1| x2-x1
F= 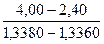 = (1,3370+1,3360) = 3,20 %
= (1,3370+1,3360) = 3,20 %
б) оскільки у інтервалі між n1, n2 зберігається лінійна залежність між n та х, то розраховуючи х, можна скористатись лінійною інтерполяцією:
ЕТАЛОННА ВІДПОВІДЬ
Варіант №4
1. Сутність кондуктометричного методу аналізу.
Засновником кондуктометричного аналізу вважають німецького фізика-хіміка Ф.В.Г. Кольраум (1840-1910), який вперше у 1885 році запропонував порівняння зв‘язку розчинів сильних електролітів та концентрацій. У середині минулого століття було розроблено метод високочастотного кондуктометричного титрування.
Кондуктометричний аналіз заснований на використанні залежності між електропровідністю розчинів електролітів і їх концентрацій.
Електричний опір (R) шару розчину електроліту між електродами прямо пропорційний довжині (l) цього шару і оборотньо-пропорційний площі (S) поверхні електродів:
R = S  =
=  .
.
Із збільшенням концентрацій розчину електроліту його питома електропровідність спочатку збільшується, а потім проходить через молекули і зменшується.
У розчинах слабких електролітів із збільшенням концентрації понижується ступінь дисоціації молекул електроліту, що призводить до зменшення числа іонів – струмопровідних частинок – зменшується питома електропровідність.
Питома електропровідність розчинів електролітів збільшується з ростом температури протягом зниження в‘язкості розчинів, що призводить до збільшення швидкості руху іонів, а для слабких електролітів – також, і до збільшення їх ступеню іонізації. Тому вимір проводять при постійній температурі.
Відповідно до закону незалежного руху іонів – Кольраума, еквівалентна електропровідність розчину електроліту дорівнює їх рухомості розбавленого чи розведеного розчину.
У кондуктометричному методі аналізу застосовують пряму кондуктометрію і кондуктометричне титрування.
2. Дати характеристику a, b, g випромінюванням.
Промені a, b складаються з частинок, які мають заряд, а g-промені не мають електричного заряду.
Промені, що не відхиляються у магнітному полі і ті, що не несуть електричного заряду - g промені – це електромагнітне випромінювання схоже з рентгенівським променем, які забезпеченні великою проникливою здатністю.
Промені, протилежні напрямку відхилень свідчать про те, що у склад одного пучка входять негативно заряджені частини - b промені, а у склад іншого a промені – частинки, що мають позитивний заряд.
З‘ясовано, що a промені складені з частинок, маса яких дорівнює вазі атому гелію, а абсолютна величина заряду – подвоєному заряду електрона.
Електрон – це елементарна частинка, яка володіє найменшим, існуючим у природі, від‘ємний електричний заряд – 1,602×1019Ка.
Маса електрону дорівнює 9,1095×10-28г, тобто майже у 2000 разів менше маси атому водню.
Атом – це складні утворення, які побудовані з більш дрібних структурних одиниць.
Велику роль у встановленні складної природи атому і розшифровки його структури стало відкриття і вивчення радіоактивності.
Радіоактивність – це явище випускання декількох елементарних вилучень, які можуть проходити через речовини, іонізувати повітря.
Вивчення подружжя Кюрі і Е. Резерфорда встановили, що радіоактивне вилучення неоднорідне і під дією магнітного поля воно розділяється на три пучки один з яких не змінює свого первинно вибраного напрямку, а два інших відхиляються у протилежні напрями.
Таким чином, промені, які не відхиляються і не мають електричного заряду - g промені. Протилежні, напрямом відхилення свідчать, про те, що у склад одного пучка входять від’ємна заряджені частинки - b промені, у склад іншого - a промені, частинки, які володіють додатковим зарядом.
3. Задача.
Константа дисоціації масляної кислоти ( 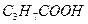 ) дорівнює 1,54
) дорівнює 1,54  10
10  . Визначити степінь дисоціації водного розчину кислоти при розбавленні V=1024 л/г-екв, концентрацію іонів водню в цьому розчині і еквівалентну електропровідність при безкінечному розбавленні, якщо
. Визначити степінь дисоціації водного розчину кислоти при розбавленні V=1024 л/г-екв, концентрацію іонів водню в цьому розчині і еквівалентну електропровідність при безкінечному розбавленні, якщо  .
.
Рішення:
По відомій константі дисоціації при концентрації розчину, дорівнює  г-екв/л, знайдемо степінь дисоціації за рівнянням:
г-екв/л, знайдемо степінь дисоціації за рівнянням:
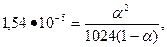
звідки
 .
.
Так як концентрація іонів водню дорівнює загальній концентрації кислоти, помножений на степінь дисоціації, то

Загальну еквівалентну електропровідність  знайдемо за рівнянням:
знайдемо за рівнянням:
 .
.
ЕТАЛОННА ВІДПОВІДЬ
Варіант №5
1. В чому сутність методів біотестування.
Біологічні методи основані на використанні біологічних об’єктів і засновані на фіксації реакції живих організмів, клітин тощо. До цих методів належить біоіндикація (спосіб оцінки якості середовища за реакцією на нього живих організмів та їх спільнот) та біотестування (використання у контролюємих умовах біологічних об’єктів (тест-об’єктів) для виявлення та оцінки інтегральної дії факторів (у тому числі, й токсичних) середовища на систему організмів, окремий організм в цілому, його окрему функцію). В основі цих методів є порівняння поведінки тест-об’єктів у середовищі, що вивчається, та, так би мовити, у "чистому" середовищі. Біотестування дає змогу за відповідною реакцією тест-організму отримати інтегральну інформацію за всією сукупності впливових (токсичних) агентів, які чинять вплив на тест-об’єкт. Завдяки простоті, оперативності та доступності, біотестування отримало широке визнання у всьому світі.
На сучасному етапі відома велика кількість методів біотестування, але стандартизованих не так вже й багато (в Україні це тести з прісноводними рибами, ветвистовусими та жаброногими ракоподібними, водоростями, інфузоріями, бактеріями, які світяться). Біотестування можливо проводити на популяційно-видовому, органо-тканинному, клітинному, субклітинному та молекулярному рівнях.
Як правило, тест-об’єкт – це чутливий біологічний елемент, здатний реагувати на зовнішній вплив. Ним можуть бути ферментативні системи, ізольовані органели, клітини, тканини, окремі органи багатоклітинних організмів, одноклітинні та багатоклітинні організми одного біологічного виду або кількох видів. Фіксація тест-реакції при біотестування здійснюється за допомогою візуальних спостережень або за допомогою приладів. Так, візуальні спостереження проводяться при визначенні виживаності, плодючості, поведінкової реакції та реакції росту, а прилади застосовують при визначенні іммобілізації клітин, біолюмінесценції, флуоресценції, активності окисних ферментів, зміні фізіолого-біологічних показників мікроскопічних організмів та фізіологічних показників риб. При цьому використовують такі прилади, як мікроскоп, люменометр, флуорометр, електрокардіограф або електроенцефалограф, фотоелектрокалориметр, спектрофотометр та спектрометр. Таким чином, спостерігається поєднання біологічних та приладових методів.
Біотестування висуває ряд вимог, дотримання яких є необхідним для отримання достовірних результатів. Серед останніх можна назвати наступні: відносна швидкість проведення досліджень, отримання достатньо точних і відтворюваних результатів, присутність об’єктів, застосовуваних у біотестуванні у великій кількості і з однорідними властивостями, а також діапазон похибки у порівнянні з іншими методами тестування не більше 20%.
Для дотримання всіх перелічених вимог методи біотестування необхідно вдосконалювати, в їх поєднанні з методами, що реалізуються за допомогою приладів. Прилади дають більш точні результати у порівнянні з візуальними спостереженнями, а застосування комп’ютерної техніки дозволяє автоматизувати процес біотестування, прискорити обробку отриманої інформації та забезпечити точність результатів математичних розрахунків.
Необхідністю застосування біологічних методів оцінки якості питної води не викликає сумнівів, але постає питання, - який саме тест-об’єкт використовувати, на якому рівні організації організму зупинитись, щоб ступінь реакції тест-об’єктів на якість питної води максимально наблизився до ступеня впливу води на людину.
На підставі наших досліджень, ми вважаємо, що прикладами найбільш придатних біологічних методів визначення якості питної води є:
- автоматизоване визначення рухливої активності інфузорії за допомогою приладу Біотестер-2;
- реєстрації параметрів руху мікроорганізмів за допомогою лазерної допплерівської спектроскопії (ЛДС) .
Ці методи основані на визначенні рухливої активності мікроорганізмів (інфузорій та одноклітинної прісноводної водорості Pedinomonas teniussima Masyuk). Тест-об’єкти є одночасно і клітиною, і організмом, а тому дозволяють дослідити вплив як на клітинному, так і на органічному рівнях: здійснюється облік рухливої активності інфузорії (кількість рухливих клітин в аналізуємій зоні) та параметрів руху водорості (доля рухливих мікроорганізмів, кількість клітин в одиниці об’єму, середня швидкість поступового руху клітин, відносні енерговитрати популяції на рух, зміна чутливості клітин до зовнішнього впливу). Відмінність методів у тому, що у другому варіанті реєструється більша кількість параметрів, що дає змогу більш точного визначення впливу, а також більша експресність методу (1 проба за 2 хвилини на відміну від 15 проб за 1,5 години у першому варіанті).
Аналіз методів визначення якості питних вод та вимоги до них показує, що на першому етапі оцінки якості необхідно використовувати біотестування. Серед різних методик біотестування перевага належить методу реєстрації параметрів руху мікроорганізмів за допомогою ЛДС. Оскільки він відповідає всім вимогам, які висуваються до біотестування, а саме: висока швидкість проведення досліду (за кілька секунд визначаються параметри від сотень до десятків тисяч клітин), отримання точних та відтворюваних результатів (облік здійснюється за допомогою комп’ютерної програми, з побудовою графіків та таблиць), присутність тест-об’єкту у великій кількості і з однорідними властивостями (причому використовуються рухливі клітини різного еволюційного рівня – від простіших та мікроводоростей до гамет ссавців), діапазон погрішності при реєстрації параметрів складає 1-2 %. Такі високі показники методу дозволяють його застосовувати для визначення токсичності будь-якого водного середовища і, навіть, для визначення якості питних бутильованих вод, де концентрації домішок досить низькі.
2. На чому заснований кількісний флуоресцентний аналіз.
Класифікують явища люмінесценції за часом та методом збудження. За часом післясвітіння розрізняють два типи люмінесценції – флуоресценцію – світіння яке миттєво зникає після припинення дії джерела збудження і фосфоресценцію, світіння, продовжується певний проміжок часу.
Флуоресцентний аналіз – заснований на використанні флуоресценції вилучаємої речовини, збуджуємого енергією вилучення І.Ф. і у видимій області спектру.
Метод кількісного флуоресцентного аналізу заснований на використанні прямої пропорційної залежності між інтенсивністю флуоресценції (І ст.) і концентрацією з виявляємою речовиною у розчині:
Іст=КС;
Де К – коефіцієнт пропорційності.
3. Задача.
Розрахувати умовний реальний потенціал хінгідронного електроду (окислювального-відновлювального електроду), при кімнатній температурі, якщо його стандартний потенціал при цій температурі дорівнює t0 – 0,699 В, а значення рН розчину складає рН=3,0.
Розв‘язок:
Реальний умовний потенціал хінгідродного електроду Рt і хінгідрон, Н+ дорівнює цілі зкладеної з хінгідродного електроду та його стандартного водородного електроду:
В розчині хінгідрода встановлюються рівновага:
С6Н4О2×С6Н4(ОН)2=С6Н4(ОН)2=С6Н4О2+С6Н4(ОН)2
На правому електроді відбувається реакція:
С6Н4О2+2Н2+2е = С6Н4(ОН)2,
А(Н+)прав ¹ 1.
На лівому електроді відбувається реакція:
Н2=2Н++2е; а(Н+)лев=1.
Активність іонів водоводу в розчинах на правому та лівому електродах – неоднакова.
Сумарна електрохімічна реакція С6Н4О2+Н2+2Н+прав=С6Н4(ОН)2+2Н+лев.
ЕРС дорівнює (n=2):
Е=Е0-  lg
lg  , де а(ГХ) і а(х) – активності гідрохінона та хіона відповідно.
, де а(ГХ) і а(х) – активності гідрохінона та хіона відповідно.
Активність хіонона та сідрохінона однакові: а(ГХ)=а(х)
За умовами а(Н+лев)=1, а(Н2)»р(Н2)=1, таким чином,
Е=Е0-  lg
lg  .
.
Оскільки lg а(Н+) = -рН, то для умовного реального потенціалу іонідронного електрода у загальному випадку має:
Е=Е0-0,059 рН.
Згідно за умовою Е0=0,699 В, рН=3. Тоді кінцево аналізуємо:
Е=0,699-0,059×3=0,522 В.
ЕТАЛОННА ВІДПОВІДЬ
Варіант №6