 |
|
Охарактеризувати нефелометричний і турбідиметричний методи аналізу, описати принципову схему нефелометру.
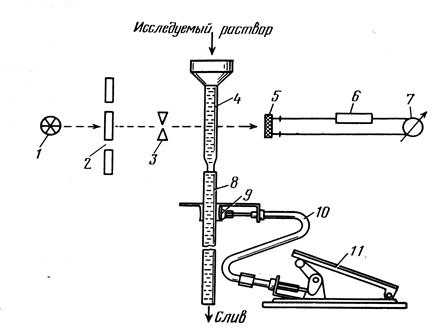
Відповідь: проходженні світла через емульсії, суспензії та інші середовища із завислими малорозчинними частинками спостерігається його послаблення унаслідок розсіяння цими частинками. Таке явище використовують при турбідиметричному і нефелометричному аналізах.
Турбідиметрія базується на вимірах інтенсивності потоку, який пройшов через розчин із завислими частинками, а при нефелометричному методі вимірюють інтенсивність світлового потоку, розсіяного розчином із цими частинками.
Інтенсивність світла І, яке пройшло через каламутне середовище, визначають зі співвідношення, подібного до закону Бугера-Ламберта-Бера:
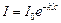 , (1)
, (1)
де I0– інтенсивність падаючого світла;
l – товщина поглинаючого шару розчину;
с – концентрація поглинаючих частинок;
k – молярний коефіцієнт каламутності.
З рівняння (45) маємо:
 , (2)
, (2)
де S – каламутність (аналогія оптичної густини).
Рівняння (2) має сенс за певних умов турбідиметричного аналізу: стала величина середнього розміру частинок, стала довжина хвилі світла тощо. Каламутність S вимірюють турбідиметрами, які за своєю будовою подібні до фотометрів і спектрофотометрів.
Інтенсивність потоку I t, розсіяного частинками розчину, визначають за законом Релея, який за умови нефелометричного аналізу (показники заломлення частинок і середовища, відстань до спостерігача, кут між падаючим і розсіяним світлом, об’єм суспензії та об’єм частинки є сталими величинами) записують так:
It = I0 Kc, (3)
де K – константа, яка враховує умови конкретного експерименту;
с – концентрація частинок;
 І0– інтенсивність падаючого світла.
І0– інтенсивність падаючого світла.
Вимірювання відношення  з метою визначення концентрації частинок с здійснюють фотометрами, або нефелометрами, побудованими за принципом фотометрів. Здебільшого серійні флуорометри мають спеціальні пристосування для нефелометричних вимірів.
з метою визначення концентрації частинок с здійснюють фотометрами, або нефелометрами, побудованими за принципом фотометрів. Здебільшого серійні флуорометри мають спеціальні пристосування для нефелометричних вимірів.
 Типовим представником серійних приладів, які виконують функції у режимах колориметра і нефелометра, є фотометр ЛМФ-72, призначений для вимірювання коефіцієнта пропускання та опричної густини забарвлених рідких середовищ у спектральному діапазоні від 365 до 750 нм.
Типовим представником серійних приладів, які виконують функції у режимах колориметра і нефелометра, є фотометр ЛМФ-72, призначений для вимірювання коефіцієнта пропускання та опричної густини забарвлених рідких середовищ у спектральному діапазоні від 365 до 750 нм.
У режимі нефелометра детектор приладу (фотоелемент) розташований під прямим кутом до падаючого на досліджуваний розчин випромінювання, щоб зафіксувати інтенсивність його розсіяної компоненти. Застосування проточних (крім звичайних) кювет (рис. 1) дає змогу уникнути трудомістких операцій заповнення, встановлення, заміни змінних кювет, здійснювати масові аналітичні визначення.
Фотометр використовують також як індикатор точки еквівалентності при флуориметричному та потенціометричному титруванні.
Фотометр виконано за однопроменевою двоканальною схемою з модуляцією світлового потоку. Оптичну схему представлено на рис. 2. Світловий потік від лампи розжарювання 1 формується за допомогою конденсора 2 та об’єктива 3 і спрямовується через регулюючу щілинну діафрагму 4 на модулятор 5. Промодульований світловий потік, пройшовши через змінний інтерференційний чи абсорбційний світлофільтр 6, тепловий світлофільтр 7 і одну з двох кювет 8 (вимірювання чи порівняння), потрапляє на фотоелемент абсорбціометричного каналу 11, розташований на оптичній осі. При роботі у нефелометричному і флуорометричному режимах розсіяне світло чи випромінювання люмінесценції потрапляє на фотоелемент флуориметричного каналу. При вимірюванні відносної інтенсивності люмінесценції за допомогою абсорбційного світлофільтра 9 виокремлюється спектральна смуга, яка відповідає спектральному складу випромінювання люмінесценції (фотометр оснащений 12-ма змінними світлофільтрами, які виділяють вузькі ділянки спектра у межах робочого діапазону приладу).
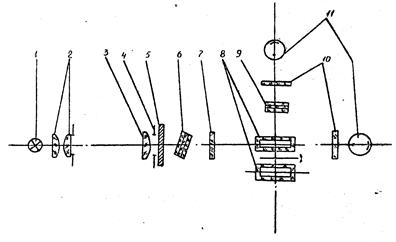 |
1 – лампа розжарювання; 2 – конденсор; 3 – об’єктив; 4 – щілинна діафрагма; 5 – модулятор; 6 – змінний інтерференційний чи абсорбційний світлофільтр; 7 – тепловий світлофільтр; 8 – кювета4 9 – абсорбційний світлофільтр; 10 – захисне скло; 11 - фотоелемент
Органи управління і регулювання фотометра та вимірювальний пристрій
(цифровий вольтметр) розташовані на лицевій панелі приладу. Вимірювальна камера винесена з корпуса фотометра і розташована у лівому верхньому куті лицевої панелі.
Загальний вигляд фотометра зображено на рис. 3.
Методика вимірів при турбідиметричному і нефелометричному методах збігається з алгоритмами фотометричних вимірювань. Градуювальні графіки будують за допомогою серії стандартних замулень різної концентрації.
Методами нефело- і турбідиметрії визначають малі концентрації багатьох йонів, які утворюють малорозчинні сполуки.
Дим і туман добре видно унаслідок світлорозсіяння, тому зрозуміло, що турбідиметричний і нефелометричний методи стають у пригоді при контролі за забрудненнями повітря. Ступінь зменшення інтенсивності лазерного променя на шляху від одного будинку до іншого пропорційна кількості частинок, яку містить повітря. За допомогою невеликого лазера і фотоелемента можливо вловити декілька міліграм частинок диму діаметра від 0,1 до 1 мкм в 1 м 3повітря.
2. Кондуктометрія. Сутність методу. Електропровідність розчинів, її залежність від концентрації. Апаратура для вимірювання електропровідності розчинів. Кондуктометричне титрування.
Вона основана на вимірюванні електропровідності розчинів. Розрізняють еквівалентну і питому електропровідність.
Питома електропровідність – це електропровідність розчину, який міститься між плоскими електродами, що знаходяться на віддалі на 1 см один від одного.
Еквівалентна електропровідність – це питома електропровідність 0,1 н розчину в електроліті.
Електропровідність розчину крім концентрації залежить ще від продуктивності йону електроліту. Чим швидше рухається йон, тим більший електричний струм проходить через розчин. Кондуктометричний аналіз проводять за допомогою кондуктометрів – приладів, які вимірюють опір розчину. По величині опору легко визначити електропровідність розчину, яка вимірюється:
L=1/R Ом
Кондуктометри (солеміри) побудовані по мостовій схемі да в комірку з розчином опускають електроди, які вмонтовані в плече моста. Міст складається із реохорда – натягнута дротина, по якій рухається бігунець постійного опору R, і вимірювального «нуль приладу» поміщеного в діагональ моста. До точок А і В підключають електричний струм і пересувають движок реохорда, знаходять точку в якій вимірювальний прилад покаже відсутність напруги (нуль). В цей момент опір комірки Rx так відноситься до постійного струму Rc, як опір плеча реохорда (дротина Lx) до опору плеча Lc:
Rc/Lc=Rx/Lx Rx=Rc*Lx/Lc
Знайшовши Rx по формулі L=1/R знаходимо L, а по калібрувальному графіку визначаємо концентрацію розчину.
Кондуктометричне титрування застосовують головним образом при реакціях нейтралізації, осадження і комплексоутворення. За допомогою кондуктометричного титрування можна визначити речовини, які не можна виконати звичайними способами об’ємного аналізу: аналіз суміші сірчаної і соляної кислот, суміші хлоридів і бромідів.
Точний об’єм аналізую чого розчину поміщають в електролітичну комірку і вимірюють його електропровідність. Результати титрування вносять в таблицю і будують графік кондуктометричного титрування: по осі абсцис відкладають об’єм прибавленого робочого розчину, а по осі ординат – електропровідність. Побудована таким чином крива кондуктометричного титрування показує зміни електропровідності розчину в ході титрування. В точці еквівалентності характер кривої змінюється переломом чи вигином кривої. Вміст аналізуючої речовини визначають за формулою:
Nx=V*N/Vx
Vx – об’єм аналізую чого розчину, взятого для аналізу, мл;
Nx – концентрація аналізую чого розчину, г*екв/л;
V – об’єм робочого розчину витраченого на титрування до ТЕ, мл;
N – концентрація робочого розчину.
3. Задача.
Знайти осмотичний тиск, якщо відомо,що молярна концентрація сахарози V0,5Mр-ну(С12H22O11) = 100мл; VH2O = 300мл; t = 25oC => T = 298K. Знайти осмотичний тиск у даному розчині?
Розв’язок:
Обчислимо кількість моль сахарози у розчині виходячи з її молярної концентрації 0,5М: за означенням молярної концентрації (відношення кількості розчиненої речовини до об’єму розчину; наприклад 1М розчин або См = 1моль/л)
0,5 моль 1000мл
ν 100мл =>ν = 0,05моль.
Після того, як ми додамо до розчину 300мл води, його об’єм стане рівним 400мл, а кількість сахарози в розчині залишиться сталою, тобто 0,05моль, тому молярна концентрація розчину стане: 0,05моль 400мл См 1000мл =>См = 0,125М Звідки осмотичний тиск:
P = CMRT = 0,125 ∙ 8,31 ∙ 298 = 309,55кПа.
ЕТАЛОННА ВІДПОВІДЬ
Варіант №18