 |
|
Вывод опыта: при электролизе KI образуются молекулы водорода и йода, в растворе накапливается гидроксид калия KOH.
Опыт №5.Нанесение гальванических покрытий.
Цинкование.
В электролизер налили электролит для цинкования (ZnSO4 - 215 г/л, A12(SO4)3 - 30 г/л, Na2SO4 - 80 г/л). Опустили в электролит предмет для цинкования (предварительно очистили и сполоснули его водой) и цинковую пластину. Соединили цинковую пластинку с положительным полюсом источника тока, а предмет для цинкования с отрицательным полюсом.
Предмет для цинкования стал блестящим через 30-40 секунд. Блестящий налет-это цинк.
Составили электронно-ионную схему процессов, происходящих на полюсах при электрическом цинковании.
ZnSO4↔Zn+2 + SO4-2
H2O ↔ H+ + OH-
К(-) А(+)
2H++2e→H2 ↑ 2H2O-4e→4H+ + О2↑
Zn+2+2e→Zn SO4-2
2H++Zn+2+ 2H2O→4H+ + О2↑+ H2 ↑ +Zn
ZnSO4+2H2O→ H2 ↑+Zn+ О2↑+ H2SO4
Меднение.
В электролизер налили электролит для меднения (состава CuSO4 - 200г/л, H2SO4 - 50 г/л). Покрываемую деталь вначале очистили, промыли водой и присоединили к отрицательному полюсу источника тока. К положительному полюсу источника тока присоединили медную пластину. Оба электрода опустили в электролизер с электролитом и начали пропускать электрический ток. Предмет для меднения начал почти сразу покрываться характерным налетом красно-оранжевого цвета.
Составили электронно-ионную схему процессов.
СuSO4 ↔Cu+2 + SO4-2
H2O ↔ H+ + OH-
К(-) А(+)
Сu+2 + 2e → Сu↓ 2 H2O-4е → 4H+ + О2↑
Н+ SO4-2
2H2O+ Cu+2→ Cu +4H++ О2↑
СuSO4 + 2H2O → О2↑ + H2↑+ Cu +H2SO4
Вывод опыта: электролиз соли металла, стоящего правее Al с растворимым анодом из того же металла позволяет покрывать какое-либо изделие этим металлом.
Вопросы и задачи:
1. Напишите молекулярные и ионные уравнения возможных реакций
вытеснения металлов из их солей другими металлами и укажите
переход электронов:
1.
a) Zn(NO3)2 + Pb → не идет
б) 2А1С13 + 3Mg → 3MgCl2 + 2Al
2Al3+ + 6Cl- + 3Mg0 → 3Mg2+ + 6Cl- + 2Al0
2Al3+ + 3Mg0 → 3Mg2+ + 2Al0
Mg0 – 2e- → Mg2+
Al3+ + 3e- → Al0
в) 2AgNO3 + Cu → Cu(NO3)2 + 2Ag
2Ag+ + 2NO3- + Cu0 → Cu2+ + 2NO3- + 2Ag0
2Ag+ + Cu0 → Cu2+ + 2Ag0
Cu0 – 2e- → Cu2+
Ag+ + e- → Ag0
г) FeSO4 + Zn → ZnSO4 + Fe
Fe2+ + SO42- + Zn0 → Zn2+ + SO42- + Fe0
Fe2+ + Zn0 → Zn2+ + Fe0
Zn0 – 2e- → Zn2+
Fe2+ +2e- → Fe0
д) Pb(NO3)2 + Hg → не идет
е) H2SO4 (рзб.) + Ni → NiSO4 + H2
2H+ + SO42- + Ni0 → Ni2+ + SO42- + H20
2H+ + Ni0 → Ni2+ + H20
Ni0 – 2e- → Ni2+
2H+ + 2e- → H2
ж) HCl (разб.) + Cu → не идет
з) Na2SO4 + Al → не идет
2. Составить схемы гальванических элементов для определения Е°
электродов Ni+2 / Ni и Сu+2 / Сu в паре с насыщенным водородным
электродом. Указать переход электронов.
H2 | 2H+ || Cu2+ | Cu
H2-2e  2H+ Cu2++2e
2H+ Cu2++2e  Cu
Cu
H2+Cu2+  2H++Cu
2H++Cu
H2 | 2H+ || Ni2+ | Ni
H2-2e  2H+ Ni2++2e
2H+ Ni2++2e  Ni
Ni
H2+Ni2+  2H++Ni
2H++Ni
 | ||
 |
3. Вычислить ЭДС медно-цинкового гальванического элемента,
рассчитать при концентрациях электролитов 1.5 M CuSO4 и 0.01 M ZnSO4.
 Дано: Решение:
Дано: Решение:
Cu, Zn Cu+2/Cu;
Cм(CuSO4)=1,5М 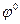 =0,34 В;
=0,34 В;
См(ZnSO4)=0,01М Zn+2/Zn

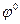 =-0,76 В;
=-0,76 В;
ЭДС( 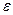 )-?
)-? 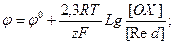



Ответ: 
4. Найти среди ниже приведенных окислительно-восстановительных пар
возможные.
a) JO2 -/ J2; б) РbО2 / Рb+2; в) Со+3/ Со+2; г) Вг2/2Вr; e)J2 / 2J-.
Решение:
a)2Na++2IO2 +2H++2e  I2+2Na++2OH-+O2
I2+2Na++2OH-+O2
б) PbO2/ Рb+2
PbO2+SO4-2+4H++2e  Pb+2 SO4 +2H2O;
Pb+2 SO4 +2H2O;
в) Со+3/ Со+2
Со+3 +e  Со+2;
Со+2;
г) Вг2/2Вr
Вг2 (ж)+2e  2Вr-;
2Вr-;
е) J2 / 2J-
J2 (к)+2e  2J-.
2J-.
5.
| NiSO4 ↔ Ni2+ + SO42- HOH ↔ H+ + OH- | ||
| K (–) Ni2+ + 2e- → Ni0 | A (+) 2HOH – 4e- → O2 + 4H+ | |
| 2HOH + 2e- → H20 + 2OH- | SO42- |
Ni2+ + 4H2O → Ni0 + H2 + O2 + 2OH- + 4H+
NiSO4 + 2H2O  Ni + H2 + O2 + H2SO4
Ni + H2 + O2 + H2SO4
| AgNO3 ↔ Ag+ + NO3- HOH ↔ H+ + OH- | |||
| K (–) Ag+ + e- → Ag0 | A (+) 2HOH – 4e- → O2 + 4H+ | ||
| H+ | NO3- | ||
4Ag+ + 2HOH → Ag0 + O20 + 4H+
4AgNO3 + 2HOH  Ag + O2 + 4HNO3
Ag + O2 + 4HNO3
| CuCl2 ↔ Cu2+ + 2Cl- HOH ↔ H+ + OH- | |||
| K (–) Cu2+ + 2e- → Cu0 | A (+) 2Cl- – 4e- → Cl20 | ||
| H+ | OH- | ||
Cu2+ + 2Cl- → Cu0 + Cl20
CuCl2 + HOH  Cu + Cl2 + HOH
Cu + Cl2 + HOH
6.
| Дано: I = 15 A t = 1 час | 3600 с | Решение:
m = 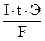 Эквивалент железа в соединении равен 28 г-экв.
m (Fe) =
Эквивалент железа в соединении равен 28 г-экв.
m (Fe) =  15,67 (г) 15,67 (г)
|
| m (Fe) – ? |
Ответ: 15,67 г.
7.
| Дано: I = 5A m = Э | Решение:
m = 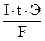 → m∙F = I∙t∙Э
F = I∙t → t = F/I
t = 96500/5 = 19300 (c) = 5 ч 21 мин 40 с → m∙F = I∙t∙Э
F = I∙t → t = F/I
t = 96500/5 = 19300 (c) = 5 ч 21 мин 40 с
|
| t – ? |
Ответ: 5 ч 21 мин 40 с.