 |
|
Дослід 5. Визначення окислювання води.
Окислюваність води - це умовна величина, що характеризує забруднення води різними речовинами, які легко окислюються. Вода забруднюється головним чином речовинами органічного та неорганічного походження, здатними до окислення ( 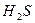 ,
,  ,
, 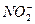 ). Щоб розрахувати окислюваність, яка стосується лише органічних речовин, вводять поправку на окислення неорганічних речовин. Визначивши окремо вміст заліза, сульфідів, нітратів і величину загальної окислюванності, роблять перерахунок на кисень, що окислює неорганічні домішки. При цьому враховують, що 1 мг заліза (II) відповідає 0,14 мг, 1 мг сірководню - 0,47 мг, а 1 мг
). Щоб розрахувати окислюваність, яка стосується лише органічних речовин, вводять поправку на окислення неорганічних речовин. Визначивши окремо вміст заліза, сульфідів, нітратів і величину загальної окислюванності, роблять перерахунок на кисень, що окислює неорганічні домішки. При цьому враховують, що 1 мг заліза (II) відповідає 0,14 мг, 1 мг сірководню - 0,47 мг, а 1 мг 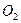 - 0,35 мг водню. Окислюваність буває перманганатна і дихроматна. Ступінь окислення перманганатом калію залежить від хімічної природи речовини, що піддається окисленню, і коливається в широких межах. При забрудненні води промисловими відходами перманганатна окислюваність не дає можливості повністю визначити забрудненість органічними речовинами. При дихроматній окислюваності визначається вміст всіх органічних речовин у воді, навіть таких, що важко окислюються. Тому дихроматна окислюваність - дуже важлива характеристика якості води.
- 0,35 мг водню. Окислюваність буває перманганатна і дихроматна. Ступінь окислення перманганатом калію залежить від хімічної природи речовини, що піддається окисленню, і коливається в широких межах. При забрудненні води промисловими відходами перманганатна окислюваність не дає можливості повністю визначити забрудненість органічними речовинами. При дихроматній окислюваності визначається вміст всіх органічних речовин у воді, навіть таких, що важко окислюються. Тому дихроматна окислюваність - дуже важлива характеристика якості води.
Для характеристики якості води визначають також біохімічне витрачання кисню (БВК). БВК - це кількість кисню, що витрачається за певний проміжок часу на аеробне біохімічне розкладання органічних речовин, які містяться у воді. Інколи визначають БВК повне, тобто вміст кисню за 5, 10, 20 діб.
Окислюваність визначається в міліграмах кисню, потрібного для окислення домішок (органічного походження), що містяться в 1 дм3 води. В чистих водах окислюваність становить приблизно 1,0 - 2,0 мг/дм3 кисню.
5.1. Визначення перманганатної окислюваності води.В конічну колбу місткістю 250 см3 наливають 20 - 100 см3 досліджуваної води, доливають 5 см3 25%-вого розчину  , доводять розчин до кипіння, нагріваючи на азбестовій сітці. Потім приливають з бюретки 10 мл 0,01 н. розчину КМnO4 і, накривши колбу годинниковим склом, кип’ятять рівно 10 хв. з моменту появи першого пухирця повітря. Після кип’ятіння рідина повинна мати червоне забарвлення, що показує на надлишок окисника. Якщо забарвлення зникло, потрібно повторити весь дослід, але для аналізу взяти менше води.
, доводять розчин до кипіння, нагріваючи на азбестовій сітці. Потім приливають з бюретки 10 мл 0,01 н. розчину КМnO4 і, накривши колбу годинниковим склом, кип’ятять рівно 10 хв. з моменту появи першого пухирця повітря. Після кип’ятіння рідина повинна мати червоне забарвлення, що показує на надлишок окисника. Якщо забарвлення зникло, потрібно повторити весь дослід, але для аналізу взяти менше води.
Знявши колбу з нагрівного приладу, у розчин додають 10 см3 0,01 н. розчину щавлевої кислоти і добре перемішують. При взаємодії щавлевої кислоти з залишком перманганату розчин знебарвлюється. Знебарвлений розчин титрують 0,01 н. розчином перманганату калію до забарвлення його в світло-рожевий колір. Окремим дослідом встановлюють кількість витраченого перманганату калію на окислення 10 см3 щавлевої кислоти, для чого в колбу наливають 5 мл 25%-ного раствора Н2SO4 і 100 мл дистильованої води, нагрівають її до кипіння , знімають колбу з нагрівного приладу, доливають 10 см3 0,01 н. розчину щавлевої кислоти і титрують до світло-рожевого забарвлення розчину перманганатом калію.
Перманганатну окислюваність води С (мг/дм3) розраховують за формулою:
 , (1)
, (1)
V1 – об’єм 0,01н розчину КМnO4, що витратили на титрування надлишку Н2С2О4 в основному досліді (мл);
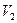 - об'єм 0,01 перманганату калію, витраченного в контрольному досліді на окислення
- об'єм 0,01 перманганату калію, витраченного в контрольному досліді на окислення
10 см3 0,01 н. розчину щавлевої кислоти, см3;
N - нормальність розчину перманганату калію;
Е - еквівалентна маса кисню, мг-екв.(0,08 – кількість кисню, що відповідає точно 1 мл 0,01н розчину КМnO4 );
 - об’єм досліджуваної води, взятої для визначення, см3.
- об’єм досліджуваної води, взятої для визначення, см3.
С - перманганатна окислюваність води, мг/дм3.