 |
|
Лабораторна робота № 3
Тема: АНАЛІЗ СИРОВИНИ
Мета заняття: Ознайомлення з методами визначення вологи в матеріалах та деяких домішок
Дослід 1. Визначення вологи методом висушування
Визначення вологи є одним з найбільш важливих моментів технічного аналізу. Волога визначається на всіх стадіях виробництва – при аналізі сировини, допоміжних матеріалів та готової продукції.
Волога може знаходитися у речовинах у вигляді гігроскопічної та кристалізаційної води. Кристалізаційну та гігроскопічну вологу визначають методом висушування (непрямий метод).
Для видалення гігроскопічної вологи наважку досліджуваного матеріалу висушують у сушильній шафі при температурі 105 – 110оС.
Кристалізаційну воду видаляють при висушуванні у сушильній шафі при температурі сушки 120 – 130оС і вище.
Для видалення поверхневої вологи сушку іноді проводять при 50 – 60оС (речовина в такому випадку вважається поверхнево-сухою).
Прилади та посуд: Ваги аналітичні ВЛА-200 г; шафа сушильна з електронагріванням та терморегулятором; ексикатор, наповнений гранульованим хлористим кальцієм; бюкси скляні.
Техніка визначення
1.1.У попередньо вимитий та висушений до постійної маси бюкс вносять наважку речовини, закривають кришкою та зважують на аналітичних вагах. Величина взятої наважки визначається як різниця зважування бюкса з наважкою і пустого бюкса.
Потім, відкривши кришку бюкса, поміщають у сушильну шафу і сушать до постійної маси.
Якщо два наступних зважування після висушування впродовж 30 хв. дають різницю не більше 0,0005 г., то маса речовини вважається постійною. Висушену наважку в бюксі з сушильної шафи переносять в ексикатор, і, коли бюкс охолодиться, зважують.
Вміст вологи (у %) визначають за формулою:
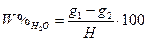 , (Ⅰ) де
, (Ⅰ) де
g1 – маса бюкса з наважкою до висушування;
g2 – маса бюкса з сухою наважкою;
Н – маса наважки досліджуваної речовини.
1.2.Розрізати целюлозу шматочками 10  10 мм та взяти наважку
10 мм та взяти наважку  5г з точністю 0,0002 г. Висушити при температурі 105 – 110оС до постійної маси. Охолоджувати в ексикаторі. Розрахувати % вологи за формулою (Ⅰ).
5г з точністю 0,0002 г. Висушити при температурі 105 – 110оС до постійної маси. Охолоджувати в ексикаторі. Розрахувати % вологи за формулою (Ⅰ).
Целюлозу можна сушити інфрачервоною лампою (лампою інфрачервоного випромінювання). У цьому випадку сушать 7 – 8 хв.
1.3.Наважку ільменіту 2,0 – 5,0 г. поміщають у попередньо висушений до постійної ваги при 105 – 110оС бюкс з кришкою і зважують з точністю до 0,0002г.
Потім бюкс з наважкою і знятою кришкою висушують у сушильній шафі при 105 – 110оС впродовж 2 годин, закривають кришкою, охолоджують в ексикаторі 30 – 40 хв. та зважують. Перед зважуванням кришку бюкса відкривають для вирівнювання тиску і швидко закривають. Повторні висушування проводять по 30 хв. до постійної ваги. Вміст вологи % розраховують за формулою (Ⅰ).
1.4. Визначення вмісту вологи за Діном та Старком.
Метод заснований на дистиляції суміші води, що міститься у пробі, та органічного розчинника, що не змішується з водою. У якості такого розчинника використовують бензол, толуол, ксилол та інші. Дистилят збирають в калібрований приймач та вимірюють об’єм відігнаної води, яка збирається на дні приймача, так як вона важча за органічний розчинник. Приймач відкалібрований на 10 мл, причому від 0 до 1 мл має ціну поділки 0,05 мл, а від 1 до 10 – 0,2 мл. Цей метод дозволяє визначити вміст вологи у багатьох органічних речовинах (як твердих, так і рідких), нафтопродуктах, ефірних оліях. Він виконується швидше, ніж метод висушування у сушильній шафі. Цим методом користуються при аналізі речовин, що містять більше 10 – 15% вологи.
Речовини: толуол або ксилол, нафта чи вугілля.

Мал.2 . Частина приладу Діна – Старка: 1 – колба круглодонна; 2 – приймач-пастка.
Хід визначення: В суху круглодонну колбу 1 приладу Діна - Старка вміщують приблизно 50 г досліджуваної речовини. Доливають в колбу 100 мл толуолу або ксилолу, приєднують до колби приймач-пастку 2 та холодильник. Колбу ставлять на колбонагрівач, нагрівають рідину до кипіння та кип’ятять до тих пір, доки водяний шар у приймачі-пастці не буде збільшуватися, а верхній шар розчинника у пастці зробиться прозорим, перегонку закінчують. Якщо на стінках приймача залишились краплини вологи, їх переносять до шару води скляною паличкою, кінець якої покритий гумовою трубкою. Потім вимірюють об’єм (V) води у приймачі.
Розрахунок: 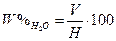 , де
, де
V – об’єм відігнаної води (мл);
Н – наважка речовини (г).
Дослід 2. Визначення домішок Fe2O3(загального) в ільменитовому концентраті
Ільменіт являється основним видом сировини для одержання диоксиду титану. Ільменіт (FeTiO3)
містить 52,6% TiO2 і 47,4% FeО. Мінерал бурого або буро-чорного кольору з питомою вагою 4,5 – 5,2 г/см3. Домішки Fe2O3 використовують як сировину для виробництва залізоокисних пігментів для лакофарбових матеріалів.
Суть методу . Наважку ільменитового концентрату переводять в розчинний стан шляхом сплавлення проби з піросірнокислим калієм. Досліджуємий розчин, одержаний після вилуговування плава 5%сульфатною кислотою, відновлюють в редукторі Джонса.
Fe+3 переходить в Fe+2, а Ті+4 _ в Ті +3. При титруванні КМnО4 витрачається і на Fe+2 і на Ті +3.
2 КМnО4 + 10 FeSO4 + 8 H2SO4 = K2SO4+2MnSO4+5Fe2(SO4)3+8H2O
2 КМnО4 + 5Ti2(SO4)3 +8 H2SO4=10 Ti(SO4)2 + K2SO4 + 2MnSO4 + 8H2O
Тому об’єм КМnО4, який пішов на титрування заліза, знаходять як різницю загального об’му КМnО4 , який витрачений на титрування Fe+2 і Ті +3 , і об’ємом ЗАК, який пішов на титрування Ті +3.
Реактиви:
Перманганат калію, ГОСТ4527-65, 0,1 н розчин
Піросірчанокислий калій, ГОСТ 7172-65, ч.д.а.
Сірчана кислота, ГОСТ4204-66, 5%-ний розчин;
Вода дистильована. ГОСТ 6709-72.
Хід визначення. Наважку приблизно 0,2 г ільменіту, подрібненого до 0, 074 мм і висушеного до постійної ваги при 105оС, беруть з точністю до 0,0002 г, ретельно перемішують у фарфоровому тиглі скляною паличкою з 7-10 г піросірнокислого калію. Зплавлення проводять у в муфельній печі при температурі 700-750 о С, видержують 10-20 хвилин, потім охолоджують і переносять сплав в склянку і вилуговують невеликою кількістю 5% сірчаної кислоти. Тигель кількісно промивають 5% H2SO4, збираючи промивні води в ту ж склянку. Загальний об’єм розчину не повинен перевищувати 50 мл. Склянку покривають часовим склом і нагрівають до повного розчинення. Потім розчин охолоджують і кількісно переносять в редуктор. Після 10 хвилин відновлення розчин зливають в колбу, редуктор тричі промивають 5% H2SO4 (кожен раз по 10 мл), і потім тричі водою, збираючи промивні води в колбу для титрування.
Одержаний розчин титрують 0,1 н КМnО4 до появи рожевого забарвлення, яке не зникає протягом 1 хвилини.
Кількість загального заліза в перерахунку на Fe2O3, % розраховують за формулою:

де Х - кількість загального заліза в перерахунку на Fe2O3, %;
а - об’єм 0,1 н КМnО4, витрачений на титрування, мл;
К1 – коефіціент поправки 0,1 н розчину КМnО4;
В - об’єм 0,1 н ЗАК, витрачений на титрування Ti3+;
К2 - коефіціент поправки 0,1 н розчину ЗАК;
0,0056 – титр точно 0,1 н КМnО4 по залізу, г/мл;
1,43 – коефіціент перерахунку Fe на Fe2O3.
Дослід 3. Визначення вмісту Na2O в карбонаті натрію
Карбонат натрію (кальцинована сода) в природі зустрічається у вигляді розсолів, рапи або у виді твердих залежей: натрона Na2CO3 . 10 H2O або трона Na2CO3 . NaHCO3 . 2H2O.
Кальцинована сода - один із найважливіших продуктів хімічної промисловості, який використовується майже у всіх сферах народного господарства: для виробництва скла , алюмінію,мила, миючих засобів, різних солей і фарб, для десульфування чавуна, очистки нафти, миття вовни, прання білизни, виробництва гідрокарбонату натрия, каустичної соди і інш.
Na2O визначаєтьься титруванням водного розчину вуглекислого натрію соляною кислотою в присутності індикатора метилового оранжевого:
Na2CO3 +2HC1 = 2 NaC1 + CO2 + H2O
Хід визначення.
Пробу ),% г соди зважують з точністю до 0,0002 г, поміщають в конічну колбу на 250 мл, розчиняють в 150 мл горячої води додають три краплі розчину метилоранжу і титрують 0,5 н розчином соляної кислоти до рожевого кольору.
Розрахунок
Вміст Na2O у % (A) розраховуємо за формулою:
А = V. К .0,0155 . 100 , де
а
V - об’єм 0,5 н розчину соляної кислоти, який затрачений на титрування, мл.
0,0155 – кількість Na2O, яка відповідає точно 0,5 н розчину соляної кислоти, г.
К – поправочний коєфіцієнт розчину соляної кислоти.
а– наважка вуглекислого натрію, г.
Контрольні питання
1. З якою метою визначають вологу в матеріалах?
2. Як визначають кристалізаційну воду?
3. Як визначають гігроскопічну воду?
4. Як визначають вологу методом висушування?
5. Як визначають воду методом Діна і Старка?
6. Намалюйте схему прилада Діна-Старка.
7. Яку наважку вугілля потрібно взяти для аналізу на вологість, якщо відомо, що там міститься 5% Н2О?
8. Маса бюксу з наважкою 18,6970 г. Маса пустого бюкса – 16,7080 г. Після висушування маса бюксу з наважкою вугілля склала – 18,5865 г. Визначити масову частку вологи у вугіллі.
9. Вологість нафти визначалась методом Діна і Старка. Після перегонки у пастці зібралося 3,3 мл Н2О. Визначте масову частку вологи у нафті, якщо наважка її була – 50 г.