 |
|
Первый закон термодинамики
Внутренняя энергия может изменяться только под влиянием внешних воздействий, то есть в результате сообщения системе количества теплоты Q и совершения над ней работы (- А):

или
 . (11)
. (11)
Это выражение представляет собой закон сохранения энергии в применении к макроскопическим системам и является математической формулировкой I-го начала термодинамики:
количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Если в изолированной системе (Q = A = 0) не происходит никаких превращений энергии, кроме теплообмена между телами, входящими в эту систему, то количество теплоты, отданное охлаждающимися при этом телами, равно количеству теплоты, полученному телами, которые нагреваются. Суммарная внутренняя энергия системы при этом не меняется.
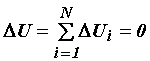 . (12)
. (12)
Уравнение (12) называется уравнением теплового баланса.
Применим первое начало термодинамики для получения выражений для теплоемкости идеального газа.
Теплоемкость системы численно равна количеству теплоты, которое необходимо сообщить системе, чтобы ее температура увеличилась на 1 Кельвин.
Если система получила количество тепла DQ, и ее температура изменилась на DT, то теплоемкость этой системы будет равна:
C = DQ/DT. (13)
Если под системой понимается 1 моль вещества, то теплоемкость называется молярной и обозначается С, если под системой понимается единица массы вещества, то теплоемкость называется удельной и обозначается cуд:
cуд = C/M. (14)
Элементарное количество теплоты DQ, сообщаемое системе, представляющей собой  молей идеального газа, для изменения ее температуры от Т до Т + DT, равно:
молей идеального газа, для изменения ее температуры от Т до Т + DT, равно:
 . (15)
. (15)
Внутреннюю энергию можно изменить двумя способами: путем передачи теплоты и путем совершения работы. При теплопередаче молекулы более нагретого тела передают часть своей энергии хаотического движения молекулам более холодного тела. Переданное количество теплоты является мерой изменения внутренней энергии каждого из тел: DU = Q.
Принято считать, что Q > 0, если тело получает энергию, и Q < 0, если тело отдает свою энергию. При совершении механической работы должно происходить направленное перемещение тел под действием сил, например, перемещение поршня в цилиндре с газом. Если газ расширяется, то сила давления газа на поршень совершает положительную работу (A > 0) за счет внутренней энергии газа. Если внешние силы больше силы давления газа, то газ сжимается и работа газа будет отрицательной (A < 0), при этом внутренняя энергия увеличивается.
В обоих случаях будет справедливо уравнение DU = – A. Если система одновременно совершает работу и получает или отдает теплоту, то изменение ее внутренней энергииDU = Q – A.
Уравнение DU = Q – A называется первым законом термодинамики (или первым законом термодинамики).
Изменение внутренней энергии термодинамической системы DU равно разности полученного количества теплоты Q и работы A, совершенной системой.
Первый закон термодинамики является законом сохранения энергии для тепловых процессов. Согласно ему A = Q – DU. Этот закон говорит о том, что любая машина (любой двигатель) может совершать работу только за счет получения извне некоторого количества теплоты или уменьшения своей внутренней энергии. Многие изобретатели пытались построить машины, которые совершали бы работу, не тратя никакой энергии. Эти машины назывались вечными двигателями первого рода.
Вечный двигатель первого рода не возможен – таков вывод из первого закона термодинамики.