 |
|
Определение постоянной Ридберга.
Оборудование;монохроматор УМ-2, водородная газоразрядная трубка, высоковольтный индуктора осветитель с ртутной лампой, неоновая лампа, спектральная лампа ЛСП (Fe ).
Цель работы:экспериментальное определение постоянной Ридберга по спектру излучения водорода.
ТЕОРИЯ.
Спектр излучения каждого химического элемента состоит из характерного для данного элемента набора спектральных линий. Количество спектральных линий может быть довольно значительным (например, в спектре железа спектральных линий с точно измеренными длинами волн более 3000),что указывает на сложность внутренней структуры атомов. Закономерности распределения спектральных линий обусловлены внутренней структурой и свойствами атомов. Поэтому эмпирический материал, накопленный при изучении спектров, послужил основным фундаментом, на котором создавалась теория строения атома
Одной из важнейших закономерностей строения атомных спектров является их сериальная структура, т.е. спектральные линии сгруппированы в отдельные серии. Длины волн спектральных линий внутри одной серии подчинены общей для данной серии закономерности. Сериальные закономерности представляют собой яркое проявление квантовых свойств излучающих атомов. В наиболее простой форме эти закономерности проявляются в спектре атома водорода и водородоподобных ионов. Именно исследование спектра атома водорода и привело к открытию сериальных закономерностей.
Первоначально была установлена закономерность для длин волн
излучения атома водорода в видимой области спектра. (4 линии  ,
, 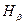 ,
, 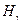 ,
,  ) которая выражается формулой:
) которая выражается формулой:

Где 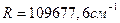 , называется постоянной Ридберга,
, называется постоянной Ридберга,  -принимает целочисленные значения 3, 4, 5, и каждому значению
-принимает целочисленные значения 3, 4, 5, и каждому значению  соответствует длина волны одной спектральной линии.
соответствует длина волны одной спектральной линии.
Данная группа спектральных линий называется серией Бальмера, по фамилии швейцарского физика, эмпирически установившего эту закономерность в 1885 г. Спектральная линия, для которой  (самая длинноволновая), называется головной линией этой серии, а длина волны при -границей серии. Граница серии Бальмера равна
(самая длинноволновая), называется головной линией этой серии, а длина волны при -границей серии. Граница серии Бальмера равна 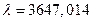 Å.
Å.
Впоследствии были открыты другие серии, длины волн которых определяются формулами:

 серия Лаймана
серия Лаймана

 серия Пашена
серия Пашена

 серия Брэккета
серия Брэккета
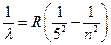
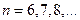 серия Пфунда
серия Пфунда
Головная линия серии Лаймана (  Ǻ) называется резонансной линией водорода, т.к. она наблюдается и в спектре поглощения водорода.Длины волн всех линий можно выразить одной формулой:
Ǻ) называется резонансной линией водорода, т.к. она наблюдается и в спектре поглощения водорода.Длины волн всех линий можно выразить одной формулой:
 , (2)
, (2)
которая называется обобщенной формулой Бальмера. Для всех спектральных линий данной серии число и  остается постоянным, а
остается постоянным, а  принимает значения начиная с
принимает значения начиная с 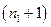 и до
и до  .
.
Теоретически формулу (2) можно получить, решив уравнение Шредингера
 . (3)
. (3)
Где  - масса электрона,
- масса электрона,  -постоянная Планка,
-постоянная Планка,  -потенциальная энергия, которая для атома водорода равна:
-потенциальная энергия, которая для атома водорода равна:
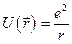 (4)
(4)
Из решения (3) вытекает, что энергия электрона в атоме водорода может принимать лишь дискретный ряд значений
 ,
,  (5)
(5)
Любая спектральная линия возникает при переходе атома с энергетического уровня с большей энергией на уровень с меньшей энергией, поэтому энергия излучаемого при этом кванта должна равняться разности энергий этих двух уровней:
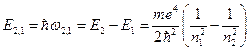 (6)
(6)
На рис.1 представлена схема расположения энергетических уровней и переходы между ними.
Учитывая, что 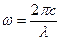 , из (6) получаем:
, из (6) получаем:
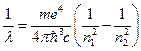 (7)
(7)
Сравнивая (2) и(7), получаем теоретическое значение постоянной Ридберга:
 (8)
(8)
В случае водородоподобных ионов в уравнении (3) меняется лишь потенциальная энергия, вместо (4) имеем:
 .
.
Где 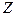 -заряд ядра.
-заряд ядра.
В этом случае для энергии электрона получается выражение:

и для длин волн
 (9)
(9)
При выводе формулы (5) не учитывалось движение ядра, т.е. принималось, что масса ядра бесконечна. При учете движения ядра вместо массы электрона следует взять приведенную массу
 ,
,
где  -масса ядра.
-масса ядра.

Метод.
Измерив длины волн в спектре водорода, по формуле
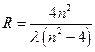 (10)
(10)
можно определить постоянную Ридберга.
Измерение длин волн спектральных линий водорода проводится на монохроматоре УМ-2. С этой целью предварительно следует построить градуировочную таблицу для монохроматора, т.е. определить, какой длине волны соответствует данное деление  шкалы измерительного барабана монохроматора Для этого пользуются спектром элемента, для которого точно измерены длины волн ряда спектральных линий. Однако, в случае спектра с большим количеством близко расположенных линий идентификация этих линий при визуальном наблюдении спектра бывает затруднительна, и требует определенной тренировки. Поэтому удобно пользоваться спектрами хотя бы двух элементов, спектр первого из которых имеет небольшое количество ярко выраженных спектральных линий, и по ним построить ориентировочную градуировочную кривую. Точное определение длины волны проводят по интерполяционным формулам. При использовании призменных спектральных приборов, когда дисперсия неравномерна по спектру, хорошие результаты дает интерполяционная формула:
шкалы измерительного барабана монохроматора Для этого пользуются спектром элемента, для которого точно измерены длины волн ряда спектральных линий. Однако, в случае спектра с большим количеством близко расположенных линий идентификация этих линий при визуальном наблюдении спектра бывает затруднительна, и требует определенной тренировки. Поэтому удобно пользоваться спектрами хотя бы двух элементов, спектр первого из которых имеет небольшое количество ярко выраженных спектральных линий, и по ним построить ориентировочную градуировочную кривую. Точное определение длины волны проводят по интерполяционным формулам. При использовании призменных спектральных приборов, когда дисперсия неравномерна по спектру, хорошие результаты дает интерполяционная формула:
 , (11)
, (11)
где  -постоянные, определяемые по трем известным линиям,
-постоянные, определяемые по трем известным линиям,  -определяемая длина волны,
-определяемая длина волны,  -отсчет со шкалы измерительного барабана, соответствующая данной линии.
-отсчет со шкалы измерительного барабана, соответствующая данной линии.
Для трех спектральных линий с известными длинами волн  определяются соответствующие деления
определяются соответствующие деления  шкалы измерительного барабана и составляются три уравнения:
шкалы измерительного барабана и составляются три уравнения:



Решение этих уравнений дает значения постоянных:
 (12)
(12)
 (13)
(13)
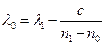 (14)
(14)
После вычисления констант следует проверить результаты подсчетов, подставив в формулу (11) последовательно  , при этом должны получиться длины волн
, при этом должны получиться длины волн  .
.
Расчет неизвестной длины волны  проводится по формуле (11) по измеренному значению
проводится по формуле (11) по измеренному значению  .
.
Опорные спектральные линии  выбираются вблизи неизвестной линии, поэтому при необходимости определения длин волн нескольких спектральных линий каждый раз выбираются опорные линии и процедура вычисления констант повторяется.
выбираются вблизи неизвестной линии, поэтому при необходимости определения длин волн нескольких спектральных линий каждый раз выбираются опорные линии и процедура вычисления констант повторяется.





 Ход выполнения работы.
Ход выполнения работы.
 | |||
 |
Рис. 2. Общий вид установки.
1 – монохроматор УМ-2; 2 – неоновая лампа; 3- ртутная лампа
включается в сеть через выпрямитель ВУП-2 (поз. 4); 5 – водород-
ная лампа работает через катушку Румкорфа (поз. 6) и выпрями-
тель ВС-4-12 (поз. 7).
1. Построить гравировочную кривую монохроматора, пользуясь ртутной лампой и неоновой лампой. Длины волн спектральных линий указанных элементов приведены в конце руководства. Отсчеты с измерительного барабана следует снимать 3-5 раз, подводя спектральную линию к указателю монохроматора каждый раз с одной и той же стороны.
Результаты измерений свести в таблицу 1.
Таблица 1
| № | Длина волны . | Цвет спектр. линии | Отсчет по барабану | Отсчет по барабану |
По данным таблицы построить график.
2.Перед щелью монохроматора установить спектральную трубку с
водородом. Схема включения водородной лампы покакзана на рис.4. Снять отсчеты по барабану для четырех линий водорода.
По градуировочному графику определить примерные длины волн этих линий.
3.Точно определить длину волны одной из линий водорода (по
указанию преподавателя). Для этого по таблицам длин волн выбрать спектр, который имеет три заметные линии  вблизи выбранной линии водорода. Установив соответствующий источник перед монохроматором, снять отсчеты
вблизи выбранной линии водорода. Установив соответствующий источник перед монохроматором, снять отсчеты  для указанных линий. Измерения занести в таблицу 2:
для указанных линий. Измерения занести в таблицу 2:
Таблица 2

| 
| 
|
Таблица 3. Спектр неона.
Спектр неона содержит большое количество красных и оранжевых спектральных линий. Дня удобства их идентификации линии объединены в группы по цвету и взаимной близости.
| Длина волны (нм) | Относит. интенсивн. | Цвет | Отсчет по шкале барабана β | β среднее | ||
| Красная | ||||||
| 671,70 | ||||||
| 667,83 | ||||||
| 659,89 | ||||||
| 653,29 | ||||||
| 650,65 | ||||||
| 640,22 | Ярко- | |||||
| 638,30 | красные | |||||
| 633,44 | ||||||
| 630,48 | ||||||
| 626,65 | Оранжевая | |||||
| 621,73 | ||||||
| 616,35 | ||||||
| 614,31 | ||||||
| 609,62 | ||||||
| 607,43 | ||||||
| 603,00 | ||||||
| 597,55 | ||||||
| 594,48 | ||||||
| 588,19 | ||||||
| 585,25 | Желтая |

Рис. 3. Спектр ртути.
Таблица 4. Спектр ртутной лампы.
В спектре ртутных ламп, кроме линий ртути, могут наблюдаться спектральные линии малой интенсивности других химических элементов из-за наличия примесей. Поэтому для построения градуировочного графика следует в первую очередь использовать самые яркие спектральные линии.
| Длина волны (нм) | Относит. интенсивн. | Цвет | Отсчет по шкале барабана β | β среднее | ||
| 690,72 | Красная | |||||
| 623,44 | Оранжевая | |||||
| 612,33 | ||||||
| 607,26 | ||||||
| 579,07 | Желтая | |||||
| 576,96 | Желтая | |||||
| 567,59 | ||||||
| 546,07 | Зеленая | |||||
| 496,03 | Голубая | |||||
| 491,60 | ||||||
| 435,84 | Три | |||||
| 434,75 | сине- | |||||
| 433,92 | фиолетовые | |||||
| 410,81 | ||||||
| 407,78 | Темно- | |||||
| 404,66 | фиолетовые |

Рис. 4. Схема включения водородной лампы.