 |
|
Лабораторная работа
Тема. Потенциометрический метод анализа. Определение рН водной вытяжки почвы, водных растворов.
Цель работы. Изучить принцип измерения рН с помощью стеклянного электрода, освоить стандартный метод определения рН буферных растворов, растворов гидролизующихся солей, природных и сточных вод.
Приборы, реактивы, посуда. Весы лабораторные 4-го класса точности с небольшим пределом взвешивания 500г; разновес; рН-метр или иономер с погрешностью измерений не более 0,05 рН; электрод стеклянный для определения активности иона водорода; электрод сравнения хлорсеребряный насыщенный образцовый 2-го разряда; взбалтыватель с возвратно-поступательным движением с частотой колебаний 75 мин; дозаторы с погрешностью дозировки не более 2% или цилиндры 2-го класса точности 4; стаканы химические вместимостью 50 мл; колба мерная вместимостью 1л; воронки; колбы конические на 250 мл; стандарт-титры для приготовления образцовых буферных растворов 2-го разряда по ГОСТ; дистиллированная вода.
Потенциометрией называют совокупность методов исследования и определения различного рода величин, основанных на измерении электродвижущих сил гальванических элементов.
Потенциометрия – незаменимый во многих случаях метод определения концентрации физиологически активных ионов (Н3О+, К+, Na+, Ca2+, NH4+, Cl–, Br–, I– и др.) в биологических жидкостях (крови, спинномозговой жидкости и др.) и тканях организма. Измерение биопотенциалов лежит в основе таких ценных диагностических методов, как электрокардиография, электроэнцефалография и др.
Потенциал, возникающий на границе раздела металл – раствор соли этого металла, называют электродным. Его величина Е определяется уравнением Нернста:
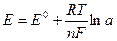
 где Е° – стандартный потенциал электродной реакции (при температуре Т = 298К и активности иона металла а = 1 моль/л); n – число электронов, теряемых атомом металла при образовании катиона; R – универсальная газовая постоянная; F – постоянная Фарадея (96500 Кл/моль).
где Е° – стандартный потенциал электродной реакции (при температуре Т = 298К и активности иона металла а = 1 моль/л); n – число электронов, теряемых атомом металла при образовании катиона; R – универсальная газовая постоянная; F – постоянная Фарадея (96500 Кл/моль).
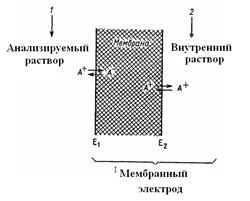
Если границей раздела фаз служит мембрана, способная избирательно обменивать ионы, входящие в ее состав, с электролитом, возникающий потенциал принято называть мембранным.
Потенциометрические методы основаны на измерении потенциалов электродов, являющихся функцией активности ионов в растворе. Поскольку измерить абсолютное значение потенциала отдельно взятого электрода невозможно, для практических целей измеряют разницу между потенциалом измерительного электрода, который зависит от активности определяемого иона, и электрода сравнения, потенциал которого известен и практически постоянен. Наиболее употребительными электродами сравнения являются каломельный и хлорсеребряный.
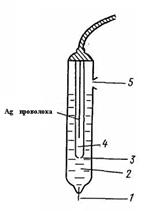
Электрод сравнения – хлорсеребряный:
1 – асбестовое волокно, которое обеспечивает контакт с исследуемым раствором;
2 – внешний раствор KCl (нас.);
3 – отверстие для контакта;
4 – внутренний раствор KCl (нас.), AgCl (т);
5 – отверстие для введения раствора KCl (нас.).