 |
|
ІІ.ІІІ. ОКСОСПОЛУКИ (АЛЬДЕГІДИ ТА КЕТОНИ)
ЗМІСТ
ІІ.3. Кисеньвмісні сполуки.
ІІ.3.1. Спирти.
ІІ.3.2. Феноли.
ІІ.3.3. Оксосполуки (альдегіди, кетони).
ІІ.3.4. Карбонові кислоти.
ІІ.4. Вуглеводи.
ІІ.4.1. Моносахариди.
ІІ.4.2. Дисахариди.
ІІ.4.3. Полісахариди.
ІІ. КИСЕНЬВМІСНІ СПОЛУКИ
ІІ.І. СПИРТИ
Спиртами називають похідні вуглеводнів, у яких один або декілька атомів водню заміщені на гідроксильну (оксі-) групу.
В залежності від числа гідроксильних груп у молекулі спирти підрозділяють на: одно-, дво-, три- та поліатомні.
ОДНОАТОМНІ СПИРТИ
Одноатомнимиспиртами (далі спирти) називають похідні вуглеводнів, у яких один атом водню заміщен на гідроксильну (оксі-) групу, зв’язану з атомом вуглецю в sp3-гібридизації.
В залежності від природи вуглеводного радикала спирти класифікують на: насичені, ненасичені, ароматичні. За природою вуглецевого атома при котрому розміщена гідроксильна група розрізняють первинні (А), вторинні (В) та третинні (С) спирти.

Номенклатура.Спирти називають за замістниковою номенклатурою ІЮПАК (як відповідні алкани, до яких додають суфікс –ол і вказують положення гідроксильної групи), в залежності від структури радикалу з яким сполучена гідроксильна група та по раціональній номенклатурі (виходячи з того, що найпростіший спирт метанол (СН3ОН) дістав назву карбінол, див. таблицю).
Ізомерія. Спиртам характерна ізомерія вуглецевого скелету, положення функціональної групи, геометрічна ізомерія для ненасичених та оптична ізомерія для спиртів, що мають асиметричний атом вуглецю (див. с. ХХХ).
Фізичні властивості.Нижчі гомологи одноатомних насичених спиртів нормальної будови, що містять до 11 атомів карбону у ланцюгу, за звичайних умов є рідкими. Вищі гомологи - тверді речовини. Густина спиртів менша одиниці.
Температури кипіння спиртів значно вище температур кіпіння відповідних вуглеводнів (метан (-161,6 оС) – метанол (64,7 оС); етан (-88,5 оС) – етанол (78,4 оС). Така відмінність зумовлена тим, що спирти є полярними сполуками і вони асоційовані за допомогою водневих зв'язків між рухливими атомами гідрогену гідроксильних груп одних молекул і вільних електронних пар атомів оксигену сусідніх молекул:

Таблиця
Номенклатура деяких спиртів
| Ф-ла спирту | Номенклатура | ||
| ІЮПАК | Від структури радикалу | Раціональна | |

| метанол | метиловий спирт | карбінол |
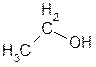
| етанол | етиловий спирт | метилкарбинол |

| бутанол-2 | втор.бутиловий спирт | метилетил-карбінол |

| фенілметанол | бензиловий спирт | фенілкарбінол |
Хімічні властивості.Атом оксигену гідроксильної групи набагато більш електронегативний, ніж сусідні атоми гідрогену та карбону.
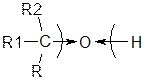
Внаслідок зміщення електронної густини до атома оксигену зв'язки О—Н і С—О поляризуються. Тому реакції спиртів можуть відбуватися з розривом як О—Н, так і С—О зв'язків. Хімічні властивості спиртів залежать також від природи вуглецевого радикала з яким з’єднана функційна група (ненасичені, ароматичні).
Кислотно-основні властивості.
Поляризація зв’язку О—Н полегшує відщеплення атома гідрогену у вигляді протона, що приводить до виявлення спиртами кислотних властивостей. Таким чином спирти реагують з лужними металами, утворюючи солі – алкоголяти:

метанол метілат натрію
Алкоголяти солі нестійкі – легко гідролізуються водою:

За рахунок однієї з вільних електронних пар атома оксигену спирти здатні приєднувати протон, тобто виявляти основні властивості:

етанол етилоксонію бромід
Спирти є амфотерними сполуками. Як кислотні, так і основні властивості у спиртів виявлені слабко (у водних розчинах не змінюють забарвлення індикаторів).
Дегідратація спиртів.
Спирти при нагріванні у присутності водовід’ємних засобів (H2SO4 конц, безводної фосфорної кислоти та ін.) відщенплюють воду. Залежно від умов проведення реакції дегідратація може відбуватися переважно в одному з двох напрямків: внутрішньо- або міжмолекулярно.
- внутрішньомолекулярно. Потребує більш високих температур, ніж міжмолекулярна дегідротація та надлишок водовід’ємних засобів. Реакція приводить до утворення алкенів:

Якщо при дегідротації можливе утворення ізомерних алкенів то відщеплення води проходить переважно за правилом Зайцева (див. с. ХХХ).
- міжмолекулярно. Реакція відбувається при надлишку спирту і приводить до утворення простих ефірів:

етанол диетиловий ефір
Заміщення групи –ОН на галоген.
При взаємодії спиртів з галогенводнями при нагріванні, галогенідами фосфору (III, V) та тіонілхлоридом утворюються галогеналкани:
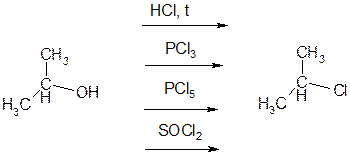
пропанол-2 2-хлорпропан
Окислення.
Окислення відбувається по-різному для первинних, вторинних і третинних спиртів. З первинних спиртів утворюються альдегіди, які при подальшому окисленні можуть переходити в кислоти:

первинний спирт альдегід кислота
Із вторинних спиртів утворюються кетони:
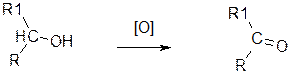
вторинний спирт кетон
Окислення третинних спиртів відбувається лише за значно жорстіших умов з розщепленням карбонового скелета і утворенням суміші кислот і кетонів (залежно від будови вихідного третинного спирту).
Способи добування.Одноатомні спирти в природі у вільному стані майже не трапляються. Однак похідні спиртів, насамперед етери та естери, досить поширені і в окремих випадках застосовуються як промислові сировинні джерела добування деяких спиртів, наприклад метанол - з лігніну деревини, високо-молекулярні спирти - з восків тощо. Користуються і декількома синтетичними методами отримання спиртів:
 - гідроліз галогеналканів. Відбувається при нагріванні спиртів в водних розчинах лугів:
- гідроліз галогеналканів. Відбувається при нагріванні спиртів в водних розчинах лугів:
2-бромбутан бутанол-2
- гідратація алкенів. У присутності мінеральних кислот (сірчана, азотна, хлорна та ін.) алкени приєднують за розривом подвійного зв'язку воду. Реакція підпорядковується правилу Марковникова (див. с. ХХХ) і приводить до утворення спиртів:

пропен пропанол-2
- відновлення оксосполук. Як відновники застосовують водень у момент виділення, або ж водень за наявності каталізаторів. Альдегіди, кислоти, естери відновлюються до первинних спиртів, кетони – до вторинних:

- бродіння. Методи бродіння застосовують для добування етанолу і бутанолу - із вуглеводнів, а також вищих спиртів - із білків.
-
ІІ.ІІ. ФЕНОЛИ
Фенолами назівають органічні сполуки які містять одну або декілька гідроксігруп, сполучених безпосередньо з ароматичним кільцем.
За числом гідроксільних груп феноли поділяють на одно- (А), двох- (В) і трьохатомні (С):

ОДНОАТОМНІ ФЕНОЛИ
Одноатомні феноли містять одну гідроксільну групу, сполучену безпосередньо з ароматичним кільцем.
Не треба плутати феноли з ароматичними спиртами:

фенол ароматичний спирт (бензіловий)
Номенклатура.. Найпростішим фенолом є гідроксибензен, його найчастіше називають просто фенолом, або карболовою кислотою. За номенклатурою IЮПАК феноли розглядають як заміщені бензени, причому нумерація починається від атома С, з яким сполучена гідрокси група. Для багатьох фенолів також застосовуються тривіальні назви (див. табл. ХХХ).
Ізомерія. Ізомерія фенолів зумовлена ізомерією положення замісників і також структурними змінами замісників.
Таблиця
Номенклатура фенолів
| Формула фенолу | Номенклатура | |
| ІЮПАК | Тривіальна | |
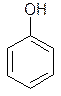
| гідроксибензен | Фенол |

| 3-метил-1-гідроксибензен м-метилфенол | м-крезол |

| 5-метил-2-ізопропіл-1-гідроксибензен 5-метил-2-ізопропілфенол | Тимол |

| 3-бром-4-етил-1-гідроксибензен 3-бром-4-етилфенол | - |
Фізичні властивості.Одноатомні феноли здебільшого є кристалічними речовинами, легко леткі з водяною парою. Феноли безбарвні, мають характерний різкий запах. Феноли розчинні в більшості органічних розчинників, а у воді обмежено розчинні лише нижчі гомологи. Високі температури кипіння фенолів порівняно з відповідними спиртами зумовлені значною асоціацією їх молекул за рахунок водневих зв'язків.
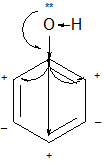 Будова фенола. Вільні пари p-електронів атома оксигену гідроксильної групи взаємодіють з π-електронами бензенового кільця, внаслідок чого утворюється спільна електронна орбіталь. Як наслідок, електронна густина зсовується від атома оксигену в бік ароматичного кільця, а оксиген, у свою чергу, відтягує до себе електронну хмару від атома гідрогену і останній стає рухливішим. У результаті кислотні властивості фенолів значно посилюються порівняно зі спиртами. Завдяки досить виразним кислотним властивостям фенол дістав назву «карболова кислота», проте він є досить слабкою кислотою порівняно навіть з карбоновими.
Будова фенола. Вільні пари p-електронів атома оксигену гідроксильної групи взаємодіють з π-електронами бензенового кільця, внаслідок чого утворюється спільна електронна орбіталь. Як наслідок, електронна густина зсовується від атома оксигену в бік ароматичного кільця, а оксиген, у свою чергу, відтягує до себе електронну хмару від атома гідрогену і останній стає рухливішим. У результаті кислотні властивості фенолів значно посилюються порівняно зі спиртами. Завдяки досить виразним кислотним властивостям фенол дістав назву «карболова кислота», проте він є досить слабкою кислотою порівняно навіть з карбоновими.
Хімічні властивості.Реакції фенолів можна підрозділити на реакції за участю зв’язків О-Н, С-О, фенільного радикалу, а також відновлення та окислення.
Кислотні властивості.
Феноли володіють сильнішими кислотними властивостями, ніж спирти. Доказом цього може бути їх реакція із лугами. Феноли взаємодіють не тільки із лужними металами (дуже енергійно), а на відміну від спиртів і з розчинами лугів, що приводить до утворення солей – фенолятів:

фенол фенолят натрію
Солі фенолів (феноляти) на відміну від солей спиртів (алкоголятів) гідролізуються не під дією води, а мінеральних кислот:

Утворення етерів та естерів.
Реакція відбувається за наявності водних розчинів лугу (феноляти більш реакційноздатні сполуки ніж феноли) під час нагрівання з алкілуючими або ацилюючими агентами:

фенолят натрію етилфеніловий етер

фенолят натрію фенілацетат
Реакції бензенового кільця.
Електрофільне заміщення в бензеновому кільці відбувається під дією групи ОН - орієнтанта 1-го роду - набагато легше, ніж у бензену і замісники заміщують гідроген в орто- і пара-положеннях.
- галогенування. Взаємодія з галогенами йде дуже легко і на відміну від бензену - без каталізаторів:

фенол 2,4,6-трибромфенол
- нітрування. Феноли нітруються вже при обробці розбавленою азотною кислотою с утворенням о- и п-нітрофенолів:

фенол о- та п-феноли
- сульфування. Феноли досить легко сульфуються. В залежності від температури утворюються різні ізомери:

фенол о- та п-феноли
При нагріванні о-ізомера до 100 оС, останній перегруповується на п-ізомер.
- синтез фенолформальдегідних смол. Феноли легко вступають у реакції конденсації з різними сполуками, зокрема, з альдегідами, за наявності кислих або лужних каталізаторів. Так, фенол із формальдегідом у присутності кислого каталізатора утворює суміш о- і п-гідроксиметілфенолів:

фенол о-гідроксифенол
Останні здатні далі реагувати с фенолом, утворюючи високомолекулярні продукти поліконденсації – новолачні смоли:

новолачна смола
Новолачні смоли застосовуються для виготовлення лаків і фенопластів.
Реакції відновлення і окислення.
- відновлення (гідрування). Гідруванняфенолу відбувається при підвищених температурі та тиску у присутністі каталізатору (подрібненого нікелю) - і є основним промисловим методом добування циклогексанолу:
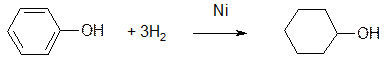
- окислення. Окислення фенолів відбувається досить легко, навіть киснем повітря, і супроводжується зміною забарвлення. Склад продуктів окислення (дво- або триатомні феноли (А), п-бензохінон (В), гідрохінон (С), дивись схему) залежить від природи окислювача й умов перебігу реакції:
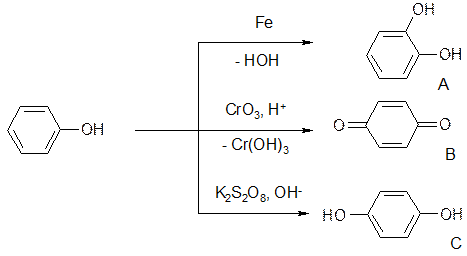
Способи добування.Поскільки світове використання фенолу досить суттеве (мільйони тонн), розроблено ряд промислових методів його добування.
- кумольний метод (із ізопропілбензену). Цей спосіб є економічно найвигіднішим, оскільки дає змогу добувати одразу два цінних продукти - фенол і ацетон, використовуючи як вихідні продукти пропан-пропенову фракцію газів крекінгу нафти та бензен:

бензен кумол гідропероксид кумолу фенол ацетон
- із бензену. Спочатку бензен активують сульфуванням або хлоруванням, а потім із бензенсульфокислоти або хлоорбензену дією лугів за жорстких умов отримують фенол:

І: + 2 NaOH, плавлення; ІІ: + NaOH розв. водн. р-н, t↑, p↑.
ІІ.ІІІ. ОКСОСПОЛУКИ (АЛЬДЕГІДИ ТА КЕТОНИ)
Альдегіди та кетони містять однакову функціональну групу >С=0 (карбонільна, або оксогрупа), тому ці сполуки називають оксосполуками, або карбонільними сполуками. Альдегіди та кетони відрізняються за природою атомів, що оточують карбонільну групу. В альдегідах оксогрупа зв’язана з вуглеводневим радикалом і атомом гідрогену, в кетонах з двома вуглеводними радикалами:

альдегідна група кетонна група
Відмінність будови альдегідів і кетонів незначна, тому і хімічні властивості цих сполук досить схожі. В залежності від будови вуглецевого радикала оксосполуки підрозділяють на насичені, ненасичені та ароматичні.