 |
|
Закон Гесса и энтальпия химических реакций
Энтальпия есть функция состояния системы, и её величина не зависит от пути перехода системы из одного состояния в другое. Это положение впервые открыл Герман Иванович Гесс (1802–1850) – русский химик, профессор Санкт-Петербургс-кого университета. В 1840 г. он сформулировал закон, который получил название закона Гесса.
Закон Гессаутверждает, что изменение энтальпии реакции зависит только от вида и состояния продуктов реакции и реагентов, но не зависит от пути прохождения реакции.
Иными словами, изменение энтальпии определенной реакции (энтальпия реакции) имеет одно и то же значение, независимо от того, проведена эта реакция в одну стадию или в несколько стадий.
Подтвердим это положение конкретными примерами.
Проведем окисление графита кислородом до СО2(г) двумя путями:

Составим термохимические уравнения этих реакций, т.е. химические уравнения, в которых дополнительно указано значение DН°.
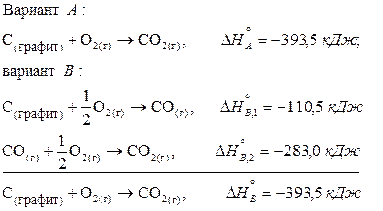
Сопоставление вариантов А и В показывает, что величины  и
и  (после суммирования уравнений реакций по стадиям и соответствующих им значений DН°) полностью совпадают. Такой результат следует из закона Гесса.
(после суммирования уравнений реакций по стадиям и соответствующих им значений DН°) полностью совпадают. Такой результат следует из закона Гесса.
Закон Гесса позволяет решать задачи, которые касаются вычисления DН° реакции, если известны энтальпии других реакций, из которых может быть составлена данная реакция.
Пример 6.4. Рассмотрим реакцию
 .
.
Вычислим энтальпию этой реакции, если известны значения DН° реакций:

Решение. Просуммируем второе и третье уравнение, чтобы получить первое. Согласно закону Гесса можно просуммировать также значения DН° этих реакций.

Комментарий. Обратите внимание на множитель (´2) справа в уравнении второй из суммируемых реакций. На эту величину нужно умножить все стехиометрические коэффициенты данной реакции, чтобы получить нужную суммарную реакцию. На эту же величину умножают значение DН°. Таким образом, при суммировании вторая реакция представлена уравнением
