 |
|
Первый закон термодинамики
Первый закон термодинамики является количественной формулировкой закона сохранения энергии в применении к процессам, связанным с превращениями теплоты и работы. Он утверждает, что энергия изолированной системы постоянна. В неизолированной системе энергия может изменяться за счет совершения работы и теплообмена с окружающей средой. Для описания этих изменений используют функцию состояния – внутреннюю энергию U и две функции процесса – теплоту Q и работу А.
Внутренняя энергия системы представляет собой ее полную энергию, обусловленную движением и взаимодействием составляющих систему молекул, атомов, ионов и образующих их частиц. Абсолютную величину внутренней энергии методами классической термодинамики определить невозможно, но можно определить ее изменение при переходе системы из начального состояния 1 в конечное 2
 .
.
Изменение внутренней энергии не зависит от пути протекания процесса, а определяется лишь конечным и начальным состояниями системы.
Согласно первому закону термодинамики теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии и совершение системой работы против внешних сил
 . (1.1)
. (1.1)
Для бесконечно малых величин
 . (1.2)
. (1.2)
Знак d в уравнении (1.2) отражает тот факт, что теплота и работа – функции процесса и их бесконечно малое изменение не является полным дифференциалом.
В уравнениях (1.1) и (1.2) используется термодинамическая система знаков: теплота положительна, если она передается системе; работа положительна, если она совершается системой над окружающей средой.
В общем случае работа является суммой нескольких качественно различных работ (механической, электрической, магнитной, поверхностной и др.). Принято все виды работ за исключением работы расширения (сжатия) называть полезной работой  . С учетом этого первый закон термодинамики примет вид
. С учетом этого первый закон термодинамики примет вид
 .
.
Если совершается только работа расширения (сжатия) pdV, то:
 . (1.3)
. (1.3)
Преобразуем уравнение (1.3) для основных термодинамических процессов.
Изохорический (изохорный) процесс осуществляется при постоянном объеме, например, в калориметрической бомбе
(V = const, dV = 0). Так как работа расширения при этом равна нулю, то, очевидно, что изменение внутренней энергии равно теплоте реакции:
|
 ,
,
QV = DU.
Изобарический (изобарный) процесс осуществляется при постоянном давлении (p = const, dp = 0). Уравнение (1.3) в этом случае запишется в виде
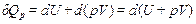 ,
,
где U + pV = H – функция состояния системы, называемая энтальпией.
С учетом этой функции получают:
|
 ,
,
Qp = DH.
Адиабатический процесс осуществляется без теплообмена с окружающей средой (dQ = 0)
 ,
,
A = –DU.
В адиабатическом процессе работа может совершаться только за счет убыли внутренней энергии.
Изотермический процесс осуществляется при постоянной температуре (T = const). В изотермическом процессе внутренняя энергия системы не меняется, а работа совершается только за счет поглощаемой теплоты (U = const, dU = 0). Тогда
 ,
,
QT = A.
Термохимия
Термохимия – раздел химической термодинамики, изучающий взаимосвязь химических и физико-химических процессов с сопровождающими их тепловыми эффектами.
В любом акте химического превращения принимает участие некоторая совокупность атомов, характеризующая исходные вещества, а после их перераспределения – и продукты реакции. Перегруппировка атомов вызвана изменением химических связей в молекулах реагирующих веществ. Поскольку внутренняя энергия исходных молекул отличается от внутренней энергии продуктов реакции, то происходит изменение внутренней энергии системы, которое сопровождается тепловым эффектом и совершением работы.
Тепловой эффект – это количество теплоты, которое система выделяет или поглощает в необратимо протекающем процессе при постоянной температуре.
Изобарный тепловой эффект процесса равен изменению энтальпии (в дальнейшем изложении – энтальпии реакции).
Изохорный тепловой эффект равен изменению внутренней энергии.
Изобарный и изохорный тепловые эффекты связаны уравнением
|
или
DH = DU + DnRT,
где Dn – изменение числа моль газообразных участников реакции.
Как видно из уравнений (1.4) и (1.5), при постоянстве давления или объема тепловой эффект приобретает свойства функции состояния, т.е. перестает зависеть от пути и определяется конечным и начальным состояниями системы.
Независимость теплового эффекта процесса от пути его протекания была установлена опытным путем в 1836 г. русским академиком Г.И. Гессом. В современной интерпретации это положение называется законом Гесса, или основным законом термохимии.
Основной закон термохимии гласит: тепловой эффект процесса (реакции) не зависит от пути (промежуточных стадий), а определяется только начальным и конечным состоянием системы при условиях:
q процесс осуществляется при V = const или при p = const;
q температура исходного и конечного состояния одинакова (однако это не означает, что она должна быть постоянной в течение всего процесса);
q процесс идет до конца.
Если не выполняется хотя бы одно из условий, основной закон термохимии не работает.
Закон Гесса позволяет решить ряд задач теоретического и прикладного характера в области энергетики слабых (Ван-дер-Ваальсовых) и сильных (химических) взаимодействий.
Процессы, идущие с поглощением теплоты (DH > 0), называются эндотермическими, с выделением теплоты (DH < 0) – экзотермическими.
Уравнениереакции с указанием агрегатного состояния реагентов и энтальпии реакции называется термохимическим уравнением.
Например, для реакции образования бензола в жидком состоянии из простых веществ термохимическое уравнение запишется:
6С (т) + 3Н2 (г) = С6Н6 (ж), DH 0 = 49,03 кДж/моль,
где символы (т), (ж) и (г) указывают на агрегатное состояние реагента. Эти символы обычно опускаются, когда агрегатное состояние реагента является очевидным в данных условиях; верхний индекс "о" указывает на то, что все реагенты взяты в стандартном состоянии.
Большинство реакций осуществляется при постоянном давлении, поэтому в термохимических расчетах обычно используются стандартные энтальпии образования.
Стандартной энтальпией образования соединения называют изменение энтальпии в реакции образования 1 моль данного соединения из элементов или простых веществ, взятых в стандартных условиях (в стандартном состоянии).
Стандартное состояние – это состояние чистого вещества при давлении 1,013×105 Па (1 атм) и заданной температуре. При этом простые вещества должны быть взяты в том агрегатном состоянии, в котором они являются термодинамически устойчивыми при выбранных условиях. В справочной литературе [2] приводятся величины, характеризующие вещество в стандартном состоянии, определяемом более узко, а именно р = 1 атм и Т = 298 К.
Стандартная энтальпия образования простых веществ условно принимается равной нулю. Стандартную энтальпию образования при Т = 298 К рекомендуется обозначать следующим образом  , где f (от англ. formation) указывает на образование соединения из простых веществ (элементов); i – соединение; j – агрегатное состояние.
, где f (от англ. formation) указывает на образование соединения из простых веществ (элементов); i – соединение; j – агрегатное состояние.
Например, стандартную теплоту образования воды при
Т = 298 К обозначают 
Для многих соединений не удается осуществить реакцию образования из простых веществ и, следовательно, нельзя измерить их теплоту образования. Однако в большинстве случаев удается осуществить реакцию полного сгорания соединения. Определяемая при этом теплота сгорания имеет не меньшее практическое значение для термохимических расчетов, чем теплота образования.
Теплота сгорания – это количество теплоты, которое выделяется при окислении единицы массы вещества до высших оксидов. При этом энтальпии сгорания оксидов (Н2О (ж), СО2 (г),
NO2 (г) и др.) условно принимаются равными нулю. В термохимических расчетах используют стандартную теплоту сгорания.
Стандартной теплотой сгорания называется теплота сгорания, отнесенная к стандартным условиям.
Значения стандартных теплот образования и сгорания при Т = 298 К приведены в справочной литературе.
В зависимости от условий различают теплоту сгорания при постоянном объеме Qv и теплоту сгорания при постоянном давлении Qp. Согласно (1.6) эти тепловые эффекты отличаются между собой на величину работы расширения.
Например, для реакции сгорания сахарозы
С12Н22О11 (т) + 12О2 = 12СО2 + 11Н2О (ж) + Qv,
Qp = Qv, так как Dn = 12 – 12 = 0;
для реакции сгорания куриного жира
С20Н32О2 (т) + 27О2 = 20СО2 + 16Н2О (ж) + Qv,
Dn = 20 – 27 = –7, в этом случае Qp ¹ Qv.
Экспериментальные данные по теплотам сгорания веществ при постоянном объеме (в калориметрической бомбе) позволяют рассчитать теплоты сгорания при постоянном давлении и, пользуясь законом Гесса, рассчитать теплоты образования соединений при стандартных условиях.
Химические превращения пищевых веществ в организме, как и любые химические реакции вне организма, подчиняются законам термодинамики. Питательные вещества, вводимые в организм, проходят до своего конечного превращения сложный путь и участвуют в большом количестве реакций. Суммарный энергетический эффект этих реакций Qp (калорийность пищевых продуктов) можно оценить по тепловому эффекту QV непосредственного сгорания в избытке кислорода единицы массы пищи. Расчеты показывают, что поправка на условия окисления (pDV) пренебрежимо мала и ее можно не учитывать, т.е. Qp = QV. Пути окисления продукта в калориметрической бомбе и в организме различны, но начальные и конечные состояния участвующих в реакциях веществ одинаковы. Процессы проходят при фиксированных условиях и до конца. Это позволяет, применив закон Гесса и уравнение (1.6), определить калорийность пищевых продуктов.
Из закона Гесса можно вывести целый ряд следствий. Рассмотрим важнейшие из них.
1-е следствие. Тепловой эффект реакции равен разности энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов:
 , (1.7)
, (1.7)
где индекс "r" – символ химической реакции (от англ. reaction).
Например, для реакции
4NH3 (г) + 5О2 (г) = 6Н2О (ж) + 4NO (г) + 



 энтальпия
энтальпия 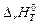 определится:
определится:

2-е следствие. Тепловой эффект реакции равен разности энтальпий сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов:
 ,
,
где индекс "с" означает сгорание (от англ. combustion).
Наиболее удобно применять следствия из закона Гесса для процессов, протекающих в стандартных условиях при Т = 298 К, так как большинство термохимических данных в справочниках приведено при этой температуре.
Часто реальные процессы осуществляются при температуре, отличной от 298 К. Для расчета тепловых эффектов при других температурах используют закон Кирхгофа: температурный коэффициент теплового эффекта равен разности суммарных мольных теплоемкостей продуктов реакции и исходных веществ. Уравнение Кирхгофа для изобарного процесса имеет вид
 , (1.8)
, (1.8)
где Dсp – разность изобарных теплоемкостей продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов;
|
 ,
,
где сp – изобарная мольная теплоемкость – количество теплоты, необходимое для нагревания 1 моль вещества на 1 градус при постоянном давлении; n – стехиометрический коэффициент участника процесса.
Характер зависимости теплового эффекта от температуры определяется знаком и величиной Dсp.
Анализ уравнения (1.8) показывает, что, если Dсp > 0, то тепловой эффект растет при увеличении температуры; при
Dсp < 0 тепловой эффект уменьшается с ростом температуры и при Dсp = 0 тепловой эффект не зависит от температуры.
При интегрировании уравнения (1.8) необходимо знать температурную зависимость теплоемкости для всех участников процесса. Ее обычно выражают эмпирическими уравнениями:
|
ср = а + bT+с'Т –2 – для неорганических веществ,
где a, b, c, c' – эмпирические коэффициенты (приведены в справочнике).
С учетом уравнений (1.9) изменениетеплоемкости запишется:
Dср = Dа + DbT + Dc×T 2 + Dс'Т -2, (1.10)
где  ,
,
 ,
,
 ,
,
 .
.
При интегрировании уравнения (1.8) с учетом (1.10) в пределах от Т1 до Т2 и от  до
до  получают:
получают:
 (1.11)
(1.11)
Если Т1 = 298 К, то  легко вычисляется по уравнению (1.7).
легко вычисляется по уравнению (1.7).