 |
|
Второй закон термодинамики. Энтропия
Второй закон термодинамики устанавливает критерии направления термодинамических процессов. Закон имеет много формулировок, одна из наиболее наглядных принадлежит Клаузиусу: теплота не может переходить самопроизвольно от холодного тела к горячему.
Математическое выражение второго начала термодинамики связано с энтропией (неравенство Клаузиуса): существует функция состояния – энтропия, которая обладает следующим свойством:
|


или  ,
,
где знак "=" относится к обратимым процессам, а знак ">" – к необратимым.
Для изолированных систем уравнение (1.12) записывается
 ,
,
т.е. энтропия изолированных систем в необратимых процессах возрастает, а в состоянии равновесия достигает максимального значения.
В обратимых процессах изменение энтропии равно нулю (энтропия – функция состояния) и уравнение (1.12) принимает вид
 .
.
Термодинамическое определение энтропииосновано на рассмотрении обратимых процессов, в которых
|

или  .
.
Энтропией называют величину S, изменение которой равно приведенной теплоте(Qобр/T), сообщенной системе в обратимом процессе.
Согласно статистической термодинамике любой самопроизвольный процесс протекает в направлении, при котором система переходит из менее вероятного состояния в более вероятное. При этом возрастает неупорядоченность системы. Мерой неупорядоченности является энтропия, которая связана с термодинамической вероятностью уравнением Больцмана:
 S = klnW, (1.14)
S = klnW, (1.14)
где k – константа Больцмана; W – термодинамическая вероятность.
Термодинамическая вероятность – это число микросостояний, с помощью которых реализуется данное макросостояние системы.
В соответствии с постулатом Планка энтропия идеального кристалла при абсолютном нуле температур равна нулю. С учетом этого может быть вычислена абсолютная энтропия вещества, т.е. энтропия, отсчитанная от своего нулевого значения при
Т = 0 К. Для расчета абсолютной энтропии вещества в любом агрегатном состоянии надо знать для каждой из фаз зависимость теплоемкости Ср от температуры, теплоту и температуру фазовых переходов.
Полная энтропия 1 моль газообразного вещества в стандартном состоянии вычисляется по уравнению
 . (1.15)
. (1.15)
Изменение стандартной энтропии 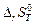 при протекании химической реакции можно рассчитать по уравнению
при протекании химической реакции можно рассчитать по уравнению
 . (1.16)
. (1.16)
При Т = 298 К стандартные энтропии приведены в справочниках. Для вычисления энтропии при другой температуре необходимо учитывать температурную зависимость теплоемкости и уравнение:
|
 (1.17)
(1.17)