 |
|
Мезомерным эффектом (М).
Мезомерный эффект изображают либо изогнутыми стрелками, либо с помощью резонансных предельных структур (см. также Рис.3):
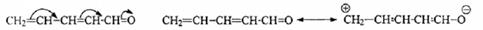
 что равнозначно следующему изображению делокализации электронов:
что равнозначно следующему изображению делокализации электронов:
Важная особенность такой поляризации - чередование (альтернирование) полярности атомов углерода. Подчеркнем, что мезомерия отражает распределениеэлектронов в молекуле или частице (статическое), а не их движение.
Знак эффекта определяют по направлению смещения: заместители, оттягивающие π-электроны от соседней двойной связи, -акцепторы электронов - обладают отрицательным мезомерным эффектом (-М);заместители, перемещающие электроны к соседней двойной связи, - доноры электронов - проявляют +М-эффект.
Все заместители, в которых есть кратные связи с участием электроотрицательного элемента, обладают -М-эффектом. Ниже сопоставлены относительные -М-эффектынекоторых заместителей:
C=CR2 < C=NR < C=O < C=S < C=N+R2
C≡CR < C=N < SO2CH3 < NO2 < СООС2Н5 < СОСН3
Увеличению -М-эффекта способствуют: наличие положительного заряда, более высокий номер группы и периода элемента в периодической системе.
Кратные связи углерод-углерод (C=С, С≡С) служат π-донорами для сопряженных с ними электроотрицательных групп типа перечисленных выше. Кроме того, +М-эффектомобладают все заместители, в которых на "центральном" атоме есть неподеленные пары электронов, способные к сопряжению с кратными связями:
–O+R2 ( + М-эффект отсутствует) < –OR < –О–
–F < –OR < –NR2
–О– < –N–R < –C–R2
I < Br < Cl < F
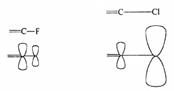 +М-эффект элементов увеличивается при движении справа налево по периодам таблицыМенделеева по мере уменьшения электроотрицательности (аналогично I-эффекту). Однако, внутри группы он растет при движении снизу вверх - параллельно увеличению электроотрицательности (см. ряд галогенов). Это противоречие объясняется пространственными требованиями к орбиталям, участвующим в сопряжении. В атоме фтора, как и в атоме углерода, в сопряжение вступают 2р-орбитали, тогда как в атомах хлора, брома и иода - 3р, 4р и 5р. Чем больше главное квантовое число (номер периода), тем больше объем p-орбитали, ее несоответствие 2p-орбитали углерода, тем менее эффективно их перекрывание:
+М-эффект элементов увеличивается при движении справа налево по периодам таблицыМенделеева по мере уменьшения электроотрицательности (аналогично I-эффекту). Однако, внутри группы он растет при движении снизу вверх - параллельно увеличению электроотрицательности (см. ряд галогенов). Это противоречие объясняется пространственными требованиями к орбиталям, участвующим в сопряжении. В атоме фтора, как и в атоме углерода, в сопряжение вступают 2р-орбитали, тогда как в атомах хлора, брома и иода - 3р, 4р и 5р. Чем больше главное квантовое число (номер периода), тем больше объем p-орбитали, ее несоответствие 2p-орбитали углерода, тем менее эффективно их перекрывание:
Таким образом, +М-эффект заместителей увеличивается, если элемент, соответствующий центральному атому, расположен левее и выше в таблице периодической системы. Кроме природы элемента, имеющего неподеленную электронную пару (пары), не менее важное значение для величины М-эффекта имеет природа связанных с этим атомом групп и наличие заряда. Электронодонорные заместители увеличивают +М-эффект, а электроноакцепторные его уменьшают или усиливают -М-эффект. Атом, несущий полный отрицательный заряд, обладает максимальным +М-эффектом, а положительно заряженный - вовсе не способен его проявить (см. приведенные выше ряды).
Подчеркнем, что электронные влияния заместителей (групп) определяются совокупностью индуктивного и мезомерного эффектов. При этом направление их может не совпадать. Так, формильная группа СН=O обладает -I и -М-эффектами, заряженные заместители -C-R2 и -О- проявляют +I и +М-эффекты, но атомы галогенов или
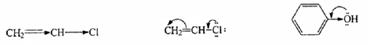 гидроксильная группа - одновременно противоположно направленные -I и +М-эффекты:
гидроксильная группа - одновременно противоположно направленные -I и +М-эффекты:
В зависимости от строения заместителя, всей молекулы или частицы и от того, какое свойство рассматривается, относительное значение I- и М-эффектов может изменяться. Например, наличие заместителя-галогена в ароматическом кольце дезактивирует последнее по отношению к электрофильному замещению (–I-эффект галогена сильнее, чем +М-эффект):

Напротив, в анизоле за счет +М-эффекта метоксигруппы электронная плотность кольца настолько высока, что -I-эффект того же заместителя практически не заметен: это соединение очень активно в реакциях электрофильного замещения.