 |
|
Влияние давления на химическое равновесие
Для реакций между идеальными газами константа равновесия KP,выраженная через парциальные давления компонент, не зависит от общего давления в системе, так как Gi0 зависит только от температуры.
Поскольку константа равновесия KC связана с KP соотношением
 ,
,
то она тоже не зависит от давления в системе. Таким образом, для реакций, участники которых ведут себя как идеальные газы, KP и KC от давления не зависят.
Однако состав равновесной смеси может зависеть от давления. При изменении общего давления в равновесной смеси в n раз парциальные давления всех участников реакции изменяются в одинаковое число раз. Если в реакции число молей газообразных веществ в правой и левой части уравнения одинаково, то состав смеси останется равновесным (нет смещения равновесия). Если же число молей газообразных веществ в правой и левой части уравнения не одинаково, то состав смеси в результате изменения давления станет неравновесным, равновесие сместится.
К аналогичному результату приводит добавление инертного газа при сохранении постоянного общего давления реакционной смеси. В этом случае объем системы увеличивается, и парциальные давления всех участников реакции уменьшаются, т.е. прибавление инертного газа равносильно расширению системы. Если инертный газ прибавляется при постоянном объеме, то изменение общего давления к сдвигу равновесия не приводит, так как остаются неизменными парциальные давления компонентов.
Рассмотрим математические выражения, описывающие влияние давления на смещение химического равновесия.


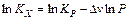
 ,
,
где DV – изменение объема в результате реакции.
Полученное уравнение дает зависимость равновесного состава реакционной газовой смеси от общего давления смеси и позволяет предсказать направление смещения равновесия при изменении давления:
- если реакция протекает без изменения числа молей газообразных веществ, то есть Dn = 0, то:
 ,
,
Xi = const, ln KX = const,
изменение давления не оказывает влияния на равновесные концентрации веществ;
- если реакция протекает с увеличением числа молей газообразных веществ, то есть Dn > 0, то:
 ,
,
увеличение давления приводит к уменьшению KX, а уменьшение давления – к увеличению KX и соответствующему изменению равновесных концентраций;
- если реакция протекает с уменьшением числа молей газообразных веществ, то увеличение давления приводит к увеличению KX, а уменьшение давления – к уменьшению KX и соответствующему изменению равновесных концентраций.