 |
|
Вязкость растворов полимеров
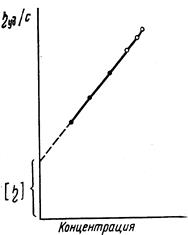
 Важнейшей отличительной особенностью растворов полимеров является их аномально высокая вязкость и быстрый ее рост с увеличением концентрации (рнс. 6.11).
Важнейшей отличительной особенностью растворов полимеров является их аномально высокая вязкость и быстрый ее рост с увеличением концентрации (рнс. 6.11).
Вязкость, или внутреннее трение жидкости, обусловлено взаимодействием молекул в жидкости. Вязкость жидкости проявляется при ее течении. Течение жидкости в капилляре (с диаметром x) характеризуется возникновением градиента скорости (du/dx) вследствие того, что слой, непосредственно примыкающий к стенке капилляра, остается неподвижным, а слой, находящийся в центре капилляра, движется с максимальной скоростью. Ламинарный поток, т.е. послойное перемещение жидкости, описывается законом Ньютона, согласно которому напряжение сдвига (t), вызывающее течение жидкости, пропорционально градиенту скорости течения:  . Коэффициент пропорциональности (h) называется коэффициентом вязкости или просто вязкостью. Единицей измерения вязкости является пуаз (П); 1 Па·c = 10 П.
. Коэффициент пропорциональности (h) называется коэффициентом вязкости или просто вязкостью. Единицей измерения вязкости является пуаз (П); 1 Па·c = 10 П.
Для разбавленных растворов на практике пользуются не абсолютной вязкостью, а рассчитывают относительную, удельную и приведенную вязкость (вязкость, отнесенная к единице концентрации):
 ;
;  ,
,  .
.
|
Определяя удельную вязкость растворов различной концентрации, можно построить графическую зависимость hуд/с от концентрации (линейная зависимость) и экстраполяцией прямой к оси ординат найти значение характеристической вязкости [h], т. е. вязкости раствора при бесконечном разбавлении, когда макромолекулы можно рассматривать как обособленные, изолированные друг от друга. Характеристическая вязкость определяет поведение изолированных макромолекул. Она представляет собой меру потерь энергии на трение изолированных макромолекул о растворитель при их вращении и поступательном движении в растворе. Поэтому характеристическая вязкость зависит как от размеров макромолекул в растворе, так и от природы растворителя и температуры раствора.
 при с®0.
при с®0. 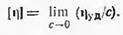
Между характеристической вязкостью и молекулярной массой полимера существует зависимость, выражаемая уравнением Марка – Куна – Хаувинка, которое первоначально было получено эмпирически:
 ,
,
где К (=10-2–10-5) — постоянная, зависящая от температуры и природы полимера и растворителя и температуры; α (0£ α £2) — показатель, характеризующий конформацию макромолекул в растворе и зависит от всех факторов, влияющих на конформацию цепи (может служить приближенной характеристикой меры свернутости макромолекул в растворе).
Для очень компактных частиц, типа эйнштейновских (глобулярные белки; ур-е Эйнштейна 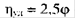 , где фи – объемная доля сферических частиц, образующих непроницаемые для растворителя клубки) α=0, для гауссовых клубков в Q-растворителе α = 0.5, для гибких макромолекул в хороших растворителях α= 0.6–0.8; для жестких макромолекул, α =1.0–1.5; для палочкообразных частиц α =1.7–2.0 (сильно заряженных полиэлектролитов 2).
, где фи – объемная доля сферических частиц, образующих непроницаемые для растворителя клубки) α=0, для гауссовых клубков в Q-растворителе α = 0.5, для гибких макромолекул в хороших растворителях α= 0.6–0.8; для жестких макромолекул, α =1.0–1.5; для палочкообразных частиц α =1.7–2.0 (сильно заряженных полиэлектролитов 2).
Для определения молекулярной массы полимера необходимо предварительное знание констант К и α. Поэтому вискозиметрический метод определения молекулярной массы полимера является относительным. Константы К и α находят, представив в логарифмической форме уравнение Марка-Куна-Хаувинка:
| lg[h]=lgK+ α lgM | () |
и определив экспериментально характеристические вязкости и молекулярные массы для серии узких фракций полимера. Молекулярные массы фракций определяют с помощью какого-либо абсолютного метода (осмометрии, светорассеяния и др.). Из прямолинейной зависимости lg[h] от lgM находят К и α.
Молекулярная масса, определяемая вискозиметрическим методом, может быть как среднечисленной, так и среднемассовой, в зависимости от того, каким методом определена молекулярная масса полимера при калибровке постоянных K и α. Более того, если использовать различные методы предварительного определения молекулярной массы, то и постоянные для одного и того же полимера будут различными даже при одной температуре.
Зависимость вязкости от концентрации раствора полимера описывается уравнением Хаггинса:
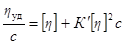 , ,
| () |
где K’ – константа Хаггинса, характеризующая взаимодействие макромолекул в данном растворителе.
Величина [h] и наклон прямой чувствительны к природе растворителя и температуре.
В хорошем растворителе макромолекулярный клубок набухает и вязкость увеличивается. Температура влияет на вязкость также, как на качество растворителя: для систем с ВКТР повышение температуры ведет к улучшению качества растворителя, вязкость растет; в системах с НКТР с ростом температуры качество растворителя ухудшается, и вязкость раствора полимера падает.
С ухудшением качества растворителя макромолекулярные клубки сжимаются, что приводит к уменьшению [h] и увеличению константы Хаггинса (К¢) в уравнении Хаггинса. В хороших растворителях K’=0.2–0.3, в плохих – K’³0.5.
Чем лучше полимер растворяется в жидкости, тем больше его уровень сольватации. Вследствие этого снижаются межмолекулярное взаимодействие между макромолекулами, затрудняется их свертывание в компактные плотные клубки, что приводит к повышению вязкости растворов. В «плохих» растворителях, слабо взаимодействующих с полимером, сольватация выражена слабо. В этих условиях макромолекулы без затруднений образуют плотные клубки небольших размеров, что обусловливает снижение вязкости растворов. Поэтому добавление к раствору полимера нерастворителя приводит к снижению его вязкости; это широко используется на практике.
Характеристическая вязкость может как возрастать, так и уменьшаться с увеличением температуры. Это зависит от термодинамического сродства растворителя к полимеру (от второго вириального коэффициента). Для систем с ВКТР термодинамическое сродство улучшается при повышении температуры (А2 возрастает), клубок разбухает больше, и [h] с повышением температуры увеличивается. У систем с НКТР с повышением температуры термодинамическое сродство уменьшается, клубок разбухает меньше, характеристическая вязкость с повышением температуры уменьшается. Если А2 с температурой меняется экстремально, т.е. система обладает ВКТР и НКТР, то клубок сжимается и при повышении, и при понижении температуры - [h] изменяется с температурой экстремально.
Ряд свойств растворов полимеров в значительной степени зависит от их концентрации. В связи с этим различают разбавленные и концентрированные растворы.
Для растворов высокомолекулярных соединений понятия концентрированного и разбавленного раствора сильно отличаются от аналогичных представлений для растворов низкомолекулярных соединений. В общем случае свойства растворов полимеров зависят от концентрации, их молекулярной массы и природы растворителя. В теории разбавленных растворов полимеров характеристическая вязкость используется в качестве критерия при оценке концентрации раствора.
Так как заключение, является раствор полимера разбавленным или умеренно концентрированным, зависит от размера макромолекул в растворе, а [h] пропорциональна объему макромолекулы в растворе, то раствор называют разбавленным (макромолекулы не взаимодействуют между собой), если для него с<1/[h], т.е. объем раствора, занятый макромолекулами, значительно меньше общего объема раствора; раствор называют умеренно концентрированным при условии с»1/[h] и концентрированным при с>1/[h] (макромолекулы растворенного полимера взаимодействуют друг с другом). Часто к концентрированным относят растворы с относительной вязкостью (представляющей собой отношение вязкости раствора к вязкости растворителя) более 100. Концентрация таких растворов находится в пределах от долей процента для длинных жестких цепей до 1% для гибких полимеров низкой молекулярной массы.
При [h]×с£1 раствор считается разбавленным (с » 0.1-1%), макромолекулы разделены растворителем и контакты между ними незначительны.
При [h]×с £10 раствор является умеренно концентрированным, такого раствора характерно взаимодействие и взаимное проникновение макромолекулярных клубков.
При [h]×с>10 раствор является высоко концентрированным. Макромолекулы в таком растворе настолько сближены и переплетены, что образуют пространственную флуктуационную сетку зацеплений. Характерным свойством такого раствора является эластичность, т. е. наличие высокоэластической деформации.
Растворы полимеров способны рассеивать свет, что обусловлено непрерывным изменением концентрации в микрообъемах системы вследствие образования и распада ассоциатов. Изменения концентрации приводят к отклонению показателя преломления от его среднего значения. По величине светорассеяния разбавленных растворов полимеров, макромолекулы которых свернуты в клубки диаметром меньше 0,1 длины волны рассеянного света, можно определить молекулярную массу полимера.
Растворы полимеров способны также избирательно поглощать световые лучи. По ультрафиолетовым и инфракрасным спектрам поглощения судят о присутствии в полимерах сопряженных двойных связей, определенных атомных групп, что помогает установить строение макромолекул.