 |
|
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ ВНЕАУДИТОРНОЙ РАБОТЫ СТУДЕТОВ ПО УКАЗАННОЙ ТЕМЕ
КОМИ ФИЛИАЛ
Государственного бюджетного образовательного учреждения высшего профессионального образования «КИРОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ»
Министерства здравоохранения и социального развития Российской Федерации
Кафедра химии, физики, биологии
Методические указания для студентов1 курса
Специальности (направления подготовки) 060101 – Лечебное дело
по самостоятельной внеаудиторной работе
по дисциплине Химия
ТЕМА: Растворы. Способы выражения концентрации. Приготовление раствора заданной концентрации.
ЦЕЛЬ: Научиться навыкам проводить расчеты, необходимые для приготовления растворов различных концентраций и умению готовить такие растворы.
ЗАДАЧИ:
1. Ознакомиться со способами выражения концентрации растворов.
2. Разобрать обучающие задачи по расчету концентрации растворов.
3. Подготовиться к лабораторной работе «Приготовление раствора NaCl заданной концентрации путем разбавления концентрированного раствора».
СТУДЕНТ ДОЛЖЕН ЗНАТЬ:
1. до изучения темы: Понятия массовой доли, количества вещества, концентрации раствора и их взаимную связь.
2. после изучения темы: Понятия: раствор, растворитель, растворенное вещество; особенности структуры воды в жидком и твердом состояниях; растворимость твердых веществ, газов в воде; факторы, влияющие на растворимость; способы выражения концентрации растворов: по растворению точной навески (объема) сухого вещества, кристаллогидрата, газа; из концентрированного раствора путем его разбавления; из разбавленного раствора путем его концентрирования; из фиксанала.
СТУДЕНТ ДОЛЖЕН УМЕТЬ:
Проводить необходимые расчеты для приготовления раствора с заданной концентрацией раствора. Пользоваться аналитическими весами, мерной посудой (пипетки, бюретки, мерные пробирки, цилиндры, мензурки) и химическими приборами (ареометр).
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ ВНЕАУДИТОРНОЙ РАБОТЫ СТУДЕТОВ ПО УКАЗАННОЙ ТЕМЕ
1) Разобрать обучающие задачи по способам приготовления растворов:
Расчеты при приготовлении, разбавлении и смешивании растворов одного и того же вещества объединяет одна общая идея – во всех случаях записывают уравнения материального баланса, связывающие характеристики конечного раствора и его исходных составляющих. В результате получают систему из двух алгебраических уравнений, решая которую, определяют искомые величины, которые необходимо взять для приготовления раствора с заданными характеристиками.
В расчетах с использованием массовой доли w(А) основу составляют два закона сохранения масс - относительно массы раствора (смеси) и относительно массы растворенного вещества, составленные на основе характеристик составных частей I и II и самого раствора (смеси):
а) - баланс по массе раствора (смеси): m(I)р-ра + m(II)р-ра = m(р-ра) (или m(смеси))
б) - баланс по массе растворенного вещества А: m(А/I) + m(А/II) = m(А/р-р) (или m(А/смеси))
Далее величины, представленные в этих уравнениях, выражают согласно условию задачи через объемы, плотности и массовые доли растворенного вещества соответствующих растворов I и II.
Следует отметить, что закон сохранения объема при смешивании растворов в общем виде не выполняется, то есть объем смеси не всегда равен сумме объемов исходных растворов(см. пример 2).
В расчетах с использованием молярной концентрации с(А) основу составляют закон сохранения количества вещества и приближенно выполняющийся закон сохранения объема раствора (смеси) в случае разбавления и смешения растворов. Последний выполняется тем точнее, чем более разбавлены смешиваемые растворы:
1) - баланс по объему смеси при разбавлении и смешивании:
Vр-ра(I) + Vр-ра(II) = Vсмеси
2) - баланс по количеству растворенного вещества:
n(А/I) + n(А/II) = n(А/смеси)
или с(А/I)Vр-ра(I) + с(А/II)Vр-ра(II) = с(А/смесь)V(смесь)
Пример 1. Какие количества составных частей I и II необходимо взять для приготовления 220 мл раствора хлорида кальция с w(CaCl2)=8%, плотность раствора r=1,066 г/мл. Рассмотреть следующие способы приготовления раствора:
а) m(CaCl2)(тв) и V(H2O) – растворение CaCl2(тв) в воде;
б) m(CaCl2·6H2O) и V(H2O) – растворение кристаллогидрата CaCl2·6H2O в воде;
в) m (CaCl2)(тв) + Vр-ра с w(СaCl2)=2% и r=1,015г/мл – концентрирование раствора
г) Vр-ра с w(СaCl2)=25% и r=1,228г/мл и V(Н2О) – разбавление концентрированного раствора;
д) Vр-ра с w(СaCl2)=25% и r=1,228г/мл и Vр-ра с w(СaCl2)=2% и r=1,015г/мл – смешивание двух растворов;
е) Vр-ра с w(СaCl2)=2% и r=1,015г/мл  концентрирование раствора путем упаривания растворителя.
концентрирование раствора путем упаривания растворителя.
Решение:
а) Составим два балансовых уравнения
1) по массе раствора: m(CaCl2) + m(Н2О) = m(р-ра) = V·r
2) по массе растворенного вещества: m(CaCl2) = V·r·w(СaCl2)
Подставляем данные из условия задачи и получаем систему двух уравнений:
m(CaCl2) + m(Н2О) = 220мл·1,066г/мл=234,52г
m(CaCl2) = 220мл·1,066г/мл·0,08=18,76г
Отсюда m(H2O)=234,52г – 18,76г = 215,76г
Ответ: для приготовления раствора необходимо 18,76г CaCl2(тв) и 215,76мл Н2О
(при условии, что r=1г/мл).
б) Рассуждая подобным образом:
1) Уравнение материального баланса по массе раствора:
m(CaCl2·6Н2О) + m(Н2О) = m(р-ра) = V·r
2) Уравнение материального баланса по массе вещества CaCl2 в растворе:
m(CaCl2/ CaCl2· 6H2O) = V·r·w(СaCl2),
где m(CaCl2/ CaCl2· 6H2O) = 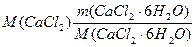 из соображения, что n(CaCl2) = n(CaCl2·6H2O)
из соображения, что n(CaCl2) = n(CaCl2·6H2O)
Система уравнений принимает вид: m(CaCl2· 6H2O) + m(Н2О) = m(р-ра) = V·r
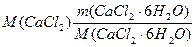 = V·r·w(СaCl2),
= V·r·w(СaCl2),
подставляем данные из условия задачи:
m(CaCl2· 6H2O) + m(Н2О) = 220мл·1,066г/мл =234,52г
 = 220мл·1,066г/мл·0,08 = 18,76г
= 220мл·1,066г/мл·0,08 = 18,76г
Отсюда m(CaCl2· 6H2O) = 
и m(H2O) = 234,52 – 37,01 = 197,51г
Ответ: для приготовления раствора необходимо 37,01г CaCl2· 6H2O и 197,51мл H2O.
в) Составим два балансовых уравнения:
1) - по массе раствора: m(CaCl2) + m1 = mр-ра или m(CaCl2) + V1r1 = Vr
2) - по массе растворенного вещества: m(CaCl2) + m(CaCl2/исх.р-р) = m(CaCl2/конечн.р-р)
или m(CaCl2) + V1· r1· w1 = V·r·w
Подставляем данные из условия задачи:
m(CaCl2) + V1·1,015г/мл = 220мл·1,066г/мл = 234,52г
m(CaCl2) + V1·1,015г/мл·0,02 = 220мл·1,066г/мл·0,08 =18,76г
Решая систему двух уравнений методом вычитания из первого уравнения второго, получаем:
V1·1,015г/мл·(1-0,02) = 234,52-18,76 = 215,76г
и V1 = 
m(CaCl2) = 234,52г-216,91мл·1,015г/мл = 14,35г
Ответ: для приготовления раствора нужно 14,35г CaCl2 и 216,91мл исходного раствора с w(CaCl2)=2%
г) Составим два балансовых уравнения:
1)-по массе раствора V1 ·r1 + m(H2O) = V·r
2)-по массе растворенного вещества V1·r1·w1 = V·r·w
получим систему: V1·r1 + m(H2O) = V·r
V1·r1·w1 = V·r·w
подставляем данные из условия задачи:
V1·1,228г/мл+m(H2O)=220мл·1,066г/мл=234,52г V1·1,228г/мл·0,25=220мл·1,066г/мл·0,08=18,76г
Отсюда  и
и
m(H2O)=234,52 – 61,11мл·1,228г/мл=159,48г
Ответ: для приготовления раствора необходимо 61,11мл исходного раствора с w(CaCl2)=25% и 159,48мл H2O.
д) Составим два балансовых уравнения:
1) - по массе раствора V1r1 + V2r2= V·r
2) - по массе растворенного вещества V1 ·r1 ·w1+ V2 ·r2 ·w2 = V·r·w
Подставляем данные из условия задачи:
V1 ·1,228г/мл +V2 ·1,015г/мл = 220мл·1,066г/мл=234,52г
V1 ·1,228г/мл·0,25 + V2 ·1,015г/мл·0,02 = 220мл·1,066г/мл·0,08=18,76г
Решая систему двух уравнений с двумя неизвестными, находим V1=49,81мл и V2=170,79мл.
Ответ: для приготовления смешанного раствора необходимо 49,81мл раствора с w(CaCl2)=25% и 170,79мл раствора с w(CaCl2)=2%.
е) При выпаривании раствора масса растворенного вещества не изменяется, а уменьшается лишь масса летучего растворителя - воды. Составим балансовое уравнение по массе растворенного вещества и определим объем исходного раствора, который необходимо взять для выпаривания:
m(CaCl2/до выпаривания)=m(CaCl2/после выпаривания)
или V1 ·r1 ·w1 = V·r·w, откуда 
Определим массу воды, которую необходимо выпарить:
m(H2O) = m(исх.р-р) - m(конечн.р-р) = V1 ·r1-V·r = 924,14мл·1,015г/мл-220мл·1,066г/мл = 703,48г.
Ответ: нужно взять 924,14мл раствора с w(CaCl2)=2% и 703,48мл H2O.
Пример 2. Какие объемы газообразного аммиака (н.у.) и его раствора с w(NH3) = 3% и плотностью r=0,985г/мл необходимо взять для приготовления 100мл нашатырного спирта (раствора с w(NH3) = 10% и r=0,957г/мл).
Решение: Запишем два уравнения материального баланса на основе двух составных частей смеси:
| I | II | Смесь |
| NH3(газ) m(NH3) | Раствор аммиака w2(NH3) = 3% r2 = 0,985г/мл V2 = ? | V(смесь) = 100мл = V w(NH3) = 10% r = 0,957г/мл |
Составляем уравнения материального баланса
1) - по массе смеси: 
2) - по массе аммиака  , где Vm=22,4л/моль.
, где Vm=22,4л/моль.
Подставив данные задачи, получим систему двух уравнений:


Решая систему из двух уравнений, находим необходимые объемы 3% раствора аммиака: V(NH3) = 8,9л.
Пример 3. Какой объем раствора соляной кислоты с w(HCl) = 20% и r = 1,098 г/мл необходим для приготовления одного литра 2М раствора?
Решение: Исходный раствор HCl является более концентрированным, чем 2М раствор и приготовление последнего связано с разбавлением первого водой. Поскольку при добавлении чистого растворителя содержание чистого вещества не меняется, то взятый для приготовления объем Vр-ра с w(HCl) = 20% должен содержать такую же массу HCl, что и конечный разбавленный раствор:
m(HCl/исх.р-р) = m(HCl/конечн.р-р) или V·r·w=c·V·M(HCl) или
V ·1,098г/мл ·0,20 = 2моль/л ·1л ·36,5 тогда V =  .
.
Ответ: объем раствора кислоты необходимый для приготовления 1л 2М раствора HCl, равен 332,4мл.
Методика приготовления 2М раствора: в мерную колбу на 1л вносят 332,4мл исходного раствора с w(HCl) = 20% и затем разбавляют дистиллированной водой до метки, до общего объема в 1л.
Если при смешивании растворов некоторых веществ протекают химические реакции, то количества реагирующих веществ находят через заданные концентрации растворов. В этих случаях важно безукоризненно знать формулировку каждого способа выражения концентрации раствора, а также формулы связи между концентрациями, количеством растворенного вещества и его массой. Кроме того, следует обратить внимание на правильное определение качественного и количественного состава раствора после окончания химической реакции, а также правильное вычисление его массы:
1) количества (n моль) продуктов реакции определяет исходное вещество, взятое в недостатке, а исходное вещество, взятое в избытке, всегда присутствует в конечной смеси веществ;
2) масса конечной смеси равна сумме масс составляющих ее исходных растворов и чистых веществ, из которой необходимо вычесть массы всех газообразных и малорастворимых продуктов реакции, которые покидают раствор;
3) объем конечной смеси приближенно равен сумме объемов исходных растворов, а при растворении твердых и газообразных веществ объем раствора считается равным объему растворителя.
Для достаточно разбавленных растворов можно принять, что rр-р @ r(H2O) = 1 г/мл.
Пример 4. В 250г раствора фосфорной кислоты с w(H3PO4) = 9,8% растворили при нагревании 14,2г оксида фосфора (V). Определить массовую долю растворенного вещества в конечном растворе.
Решение: а) При растворении P2O5 в растворе фосфорной кислоты образуется дополнительное ее количество в результате химической реакции:
P2O5 + 3H2O(растворитель) ® 2H3PO4(р-р),
поэтому масса кислоты в конечном растворе равна:
m(H3PO4) = m(H3PO4/исх.р-р) + m(H3PO4)
Рассчитаем каждое слагаемое в отдельности: m(H3PO4/исх.р-р) = mр-р ·w(H3PO4)=250г ·0,098 =24,5г
m(H3PO4/по реакции) = n(H3PO4) М(H3PO4) = = 
тогда mобщ(H3PO4) = 24,5г + 19,5г = 44,0г
б) Масса конечного раствора кислоты равна:
m(конечн.р-р) = m(исх.р-р) + m(P2O5) = 250 + 14,2 = 264,2г
и w( H3PO4/конечн.р-р)=  или 16,69%
или 16,69%
Ответ: массовая доля ортофосфорной кислоты в конечном растворе составила 16,69%.
2) Ответить на вопросы самоконтроля:
1. Влияние температуры на растворимость веществ. Растворимость газов.
2. Состав какого раствора – насыщенного, ненасыщенного, пересыщенного устойчив по отношению к небольшому изменению условий.
3. Раствор сахара в стакане оставили на некоторое время. Вскоре на дне стакана образовался осадок кристаллов. Что вы можете сказать о растворе над осадком.
4. При случайном встряхивании сосуда с раствором из него выпало большое количество кристаллов. Охарактеризуйте этот раствор.
5. Способы выражения количественного состава растворов.
3) Выучить основные расчетные формулы, используемые при решении задач:
 =
= 
 =
=  +
+ 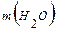
 =
= 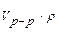
 =
= 
 =
=  [моль/л]
[моль/л] 
 =
=  [г/мл]
[г/мл]
Рекомендуемая литература:
Основная:
1. В.А. Попков, С.А. Пузаков. Общая химия: Учебник. - М.: ГЭОТАР-Медиа. - 2010.
2. С.А. Пузаков, В.А. Попков. Сборник задач и упражнений по общей химии. - М.: Высшая школа. – 2004.
Дополнительная:
1. В.И. Слесарев. Основы химии живого.- Санкт-Петербург: Химиздат.- 2001.
2. А.В. Суворов, А.Б. Никольский. Вопросы и задачи по общей химии. – Санкт-Петербург: Химиздат. – 2002.
Методические указания подготовлены: доцентами Н.И. Никитиной и Е.И. Казаковой
Методические указания утверждены на заседании кафедры №_____ от «___» ________20___ г.
Зав. кафедрой: _____________________________/Е.И. Казакова