 |
|
Третье начало термодинамики.
Включает тепловую теорему Нернста и постулат Планка. Последний имеет прикладное значение при расчёте химического равновесия.
Постулат Планка:
В области абсолютного нуля температуры энтропия правильно сформированного кристалла равна нулю (T = 0 K, S = 0). Это подтверждается и формулой Больцмана, так как при 0 K термодинамическая вероятность системы W равна 1, то S = 0. Постулат Планка не является абсолютно строгим, так как некоторые составляющие энтропии, обусловленные спиновым и изотропным эффектами, не будут равны нулю, но при протекании химических реакций ими пренебрегают. Практическое значение постулата Планка заключается в возможности теоретического расчета абсолютного значения энтропии.
Например:
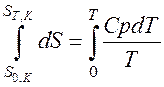 ;
;
 ;
;
Обычно справочные значения абсолютных энтропий рассчитывают в интервале 0 – 298 K. (  – справочное значение).
– справочное значение).
Теоретический расчёт химического равновесия
Теоретический расчёт химического равновесия проводят с использованием абсолютных значений энтропии.
1.Расчёт  – стандартного изменения энергии Гиббса при стандартной температуре (a = 1, T = 298 K).
– стандартного изменения энергии Гиббса при стандартной температуре (a = 1, T = 298 K).
a)  =
=  – 298∙
– 298∙  ;
;
 = ∑nкон(
= ∑nкон(  )кон – ∑n исх(
)кон – ∑n исх(  )исх;
)исх;
б)  = ∑nкон(
= ∑nкон(  )кон – ∑nисх(
)кон – ∑nисх(  )исх;
)исх;
 – изменение энергии Гиббса при образовании какого-либо соединения из простых веществ. Для простых веществ она равна нулю.
– изменение энергии Гиббса при образовании какого-либо соединения из простых веществ. Для простых веществ она равна нулю.
Примечание: при расчёте  пользуются обоими методами.
пользуются обоими методами.
2. Расчёт  (a = 1, T = любая).
(a = 1, T = любая).
a)  =
=  ;
;
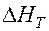 =
=  +
+  – уравнение Кирхгофа.
– уравнение Кирхгофа.
 ;
;
 ;
;
Для реакции в целом:  ;
;
 ;
;
 ;
;

 – значения двойных интегралов, рассчитанных авторами метода при соответствующих коэффициентах теплоёмкости.
– значения двойных интегралов, рассчитанных авторами метода при соответствующих коэффициентах теплоёмкости.
б)  ;
;
Заменим константы Кр на Ka, вместо ∆H подставим интегральную форму уравнения Кирхгофа, когда ∆Cp = f(T).
 ;
;
Интегрируем и домножаем обе части на –RT, учитывая
–RT×lnKa = ∆G0T
 ,
,
где Y – константа интегрирования в этом выражении. Для её определения вместо ∆G0T подставляют ∆G0298, а вместо T – 298 К. Далее расчёт проводят при температуре, которая задана.
Примечание: в расчётном задании ∆G0T считают обоими методами.
Расчёт констант равновесия (Ka, Кр, КN, Кс).
 , где а = γP, Ka = KγKp.
, где а = γP, Ka = KγKp.
Если Р ≤ 1атм., γ → 1, Kγ ≈ 1, тогда Ka = Kp.
Если Р = 1атм., то Kp = KN.
 .
.
Пример расчёта равновесного состава:
Ka = KγKp, где Kγ – константа равновесия, выраженная через коэффициенты активности. Рассчитывается для газовых реакций по справочным данным, если Р >> 1 атм. Если давление в системе не велико Kγ → 1 и Ka = Kp.
1. Область невысоких давлений (Р ≤ 1 атм.)
C2H6 ↔ C2H4 + H2 (реакционная смесь имеет стехиометрический состав). Обозначим через X конверсию исходных веществ в момент равновесия.
| Компонент | Состав, моль | |
| исходные | равновесные | |
| C2H6 | 1 – X | |
| C2H4 | − | X |
| H2 | − | X |
∑ni=1 – X + X + X=1 + X
 , где ∆n = (1 + 1) – 1 = 1.
, где ∆n = (1 + 1) – 1 = 1.
Pi = NiP;
 ;
;
 ;
;
Зная численное значение константы, найдём X:
X =  ;
;
X может быть равен нулю, то есть константа очень мала и реакция не идёт в прямом направлении. Если константа слишком велика (т. е. равновесие сдвинуто вправо), X в пределе будет равен максимальной величине стехиометрического коэффициента (при условии, что расчёт ведут по стехиометрическому составу).
2.Равновесный состав в объёмных процентах.
%i = Ni∙100%;
 =
=  =
=  ;
;
 =
=  ∙100;
∙100;
Пример заполнения таблиц и выражения констант для более сложных реакций (по стехиометрии):
3H2 + N2 ↔ 2NH3;
| Компонент | Состав, моль. | |
| исходные | равновесные | |
| H2 | 
| |
| N2 | 
| |
| NH3 | − | X |
3 моль H2 ® 2 моль NH3;
? моль H2 ® X моль NH3;
3×X = 2∙?;
? =  ;
;
1 моль N2 → 2 моль NH3;
? моль N2 → X моль NH3;
2∙? = X;
? =  ;
;


(∆ – отклонение).
Выражение константы Кс для данной реакции.

Состав не стехиометрический, а произвольный.
Например, вышеуказанная реакция имеет 1 моль H2, 2 моля N2, 0,5 моля NH3.
Сначала таблица заполняется по стехиометрии, потом – произвольно.
∆n – считается по стехиометрии.

Но при расчёте суммы молей учитывается состав, который задан.
Выражение константы равновесия для гетерогенных реакций.
Активности (парциальные давления) твёрдых фаз, принимаются равными единице, в таблицу их не включают и при расчёте константы не учитывают.
Например:

| Компонент | Состав, моль. | |
| исходные | равновесные | |
| CО | 1 – X | |
| CО2 | − | X |