 |
|
Классическая теория диссоциации электролитов. Слабые электролиты. Ионное равновесие в растворах электролитов.
1 Что наэывают степенью диссоциации электролита?
D) доля электролита, которая распадается на ионы;
2 Какое из утверждений неверно для классической теории диссоциации слабых электролитов?
С) ионы в растворе не взаимодействуют между собой
3 Как изменяется степень диссоциации слабого электролита с уменьшением его концентрации в растворе?
А) увеличивается;
4 Как изменяется степень диссоциации слабого электролита с увеличением его концентрации в растворе?
В) уменьшается;
5. Какое из уравнений справедливо для константы диссоциации слабого электролита, диссоциирующего по уравнению СН3СООН = СН3СОО- + Н+,если концентрация кислоты С, а степень диссоциации a?
Е. К = 
6. Какое из уравнений справедливо для константы диссоциации слабого электролита, диссоциирующего по уравнению KtAn = Kt+ + An-,если концентрация электролита С, а степень диссоциации a?
В. К = 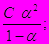
7. Какое из уравнений справедливо для константы диссоциации слабого электролита, диссоциирующего по уравнению KtAn = Kt+ + An-,если концентрация электролита С, а степень диссоциации a→ 0?
С. К = 
8. Какое из уравнений справедливо для константы диссоциации слабого электролита, диссоциирующего по уравнению НAn = Н+ + An-,если концентрация кислоты С, а степень диссоциации a  0 ?
0 ?
B. K =  ∙α
∙α
9. Какое из уравнений справедливо для константы диссоциации слабого электролита, диссоциирующего по уравнению МeOH = Me+ + OH-,если концентрация кислоты С, а степень диссоциации a  0 ?
0 ?
B. K =  ∙α
∙α
10. Какое из уравнений справедливо для степени диссоциации слабого электролита, диссоциирующего по уравнению МеОН = Ме+ + ОН-,если концентрация щелочи С, а степень диссоциации a → 0?
D. α = 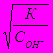
11. Какое из уравнений справедливо для cтепени диссоциации слабого электролита, диссоциирующего по уравнению НAn = Н+ + An-,если концентрация кислоты С, а степень диссоциации a  0 ?
0 ?
D. α = 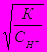
12.Какое из уравнений справедливо для определения рН раствора?
А. рН = -lg 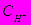 ;
;
13.Какое из уравнений справедливо для определения рОН раствора?
А. рОН = -lg  ;
;
14. Какое из утверждений справедливо для ионного произведения воды при
температуре 298 К ?
C. pH + pOH = 14
15. Какое из утверждений справедливо для ионного произведения воды при
температуре 298 К ?
C) K  = C
= C  ∙ C
∙ C 
16. Какое из утверждений справедливо для ионного произведения воды при
температуре 298 К ?
C) C  ∙ C
∙ C  = 10-14
= 10-14
17. Какое из уравнений справедливо для ионного произведения воды ?
Е. К = 
18 Как изменяется величина ионного произведения воды при увеличении температуры?
А) увеличивается;
19 Какое из уравнений справедливо для произведения растворимости малорастворимой соли AgCl ?
А. ПР = 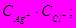
20 Какое из уравнений справедливо для призведения растворимости малорастворимоу соли PbCl2.
С) ПР= С  ∙ 2С
∙ 2С 