 |
|
ОСНОВИ ТИТРИМЕТРИЧНОГО АНАЛІЗУ
1.5.1. В титриметричному методі аналізу використовується вимірювання:
а) маси; б) об’єму;
в) тиску; г) температури.
1.5.2. Який мірний посуд застосовують для виміру об’єкту титранту:
а) мензурка; б) мірна колба;
в) бюретка; г) мірний циліндр.
1.5.3. Стандартний розчин в титриметрії – це:
а) розчин невідомої концентрації яким титрують;
б) розчин невідомої концентрації який титрують;
в) розчин відомої концентрації яким титрують;
г) розчин відомої концентрації який титрують.
1.5.3. Досліджуваний розчин в титриметрії – це:
а) розчин невідомої концентрації яким титрують;
б) розчин невідомої концентрації який титрують;
в) розчин відомої концентрації яким титрують;
г) розчин відомої концентрації який титрують.
1.5.4. Що таке титрований розчин?
а) Розчин, який досліджують титруванням;
б) Розчин, титр якого відомий до початку титрування;
в) Розчин, концентрація якого стала відомою після титрування.
1.5.4. Що таке досліджуваний розчин?
а) Розчин, який досліджують титруванням;
б) Розчин, титр якого відомий до початку титрування;
в) Розчин, концентрація якого стала відомою після титрування.
1.5.5. В титриметричних методах аналізу концентрацію робочого розчину виражають в:
а) моль/л; б) г/л; в) %; г) г•моль/л.
1.5.6. В титриметричних методах аналізу концентрацію досліджуваного розчину виражають в:
а) моль/л; б) г/л; в) %; г) г•моль/л.
1.5.7. Закон еквівалентів визначає відношення між кількістю еквівалентів досліджуваної речовини і стандартного розчину:
а) більше стандартного розчину;
б) більше досліджуваної речовини;
в) однакове;
г) менше стандартного розчину.
1.5.8. Закон еквівалентів для будь-якої пари взаємодіючих речовин можна виразити:
а)  ; б)
; б) 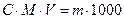 ;
;
в)  б)
б)  .
.
1.5.9. Математичний вираз закону еквівалентів:
а) СЕ1∙V1 = CE2∙V2; б)  ;
;
в) 
 ; г)
; г)  .
.
1.5.10. Титр розчину виражають в:
а) г/л; б) моль/л;
в) г/мл; г) г/моль
1.5.11. Молярну концентрацію еквіваленту речовини в розчині виражають в:
а) моль/л; б) г/моль;
в) г/мл; г) моль/кг.
1.5.12. Точкою еквівалентності називають момент реакції, коли:
а) припинено титрування;
б) спостерігається зміна середовища;
в) кількість еквівалентів досліджуваного і робочого розчину однакова;
г) кількість еквівалентів досліджуваного і робочого розчину різна.
1.5.13. Встановити точку еквівалентності в методі нейтралізації можна за допомогою:
а) зміни забарвлення індикатора;
б) нагрівання; в) перемішування;
г) додавання відповідного реагенту.
1.5.14. Індикатори – це органічні барвники складної будови, які змінюють своє забарвлення залежно від:
а) нагрівання; б) охолодження;
в) рН-розчину; г) концентрації.
1.5.15. Зміна забарвлення індикатора при кислотно-основному титруванні показує:
а) середовище розчину;
б) точку еквівалентності;
в) кількість кислоти; г) кількість лугу.
1.5.16. В якому середовищі буде точка еквівалентності при титруванні сильної кислоти сильною основою:
а) сильно кислому; б) слабокислому;
в) нейтральному; г) слабо основному.
1.5.17. В якому середовищі буде точка еквівалентності при титруванні слабкої кислоти сильною основою:
а) сильно кислому; б) слабокислому;
в) сильноосновному; г) слабоосновному.
1.5.18. В якому середовищі буде точка еквівалентності при титруванні сильної кислоти слабкою основою:
а) сильно кислому; б) слабокислому;
в) сильноосновному; г) слабоосновному.
2.5.14. В якому випадку скачок рН при титруванні буде зміщуватись в лужну сторону?
а) при титруванні слабкої кислоти лугом;
б) при титруванні сильної кислоти лугом;
в) при титруванні слабкої кислоти слабкою основою;
в) при титруванні сильної кислоти слабкою основою;
2.5.15. Точка еквівалентності при титруванні сильної основи сильною кислотою знаходиться при:
а) рН<7; б) рН>7; в) рН=7; г) рН=0.
2.5.16. Точка еквівалентності при титруванні слабкої кислоти лугом знаходиться при:
а) рН<7; б) рН>7; в) рН=7; г) рН=0.
2.5.17. Точка еквівалентності при титруванні слабкої основи сильною кислотою знаходиьться при:
а) рН<7; б) рН>7; в) рН=7; г) рН=0.
2.5.18. Що таке зворотне титрування?
а) в присутності індикатора титрування робочого розчину досліджуваним розчином;
б) титрування надлишку робочого розчину, доданого до досліджуваного;
в) титрування в присутності індикатора робочим розчином досліджуваний розчин.
2.5.19. На яких реакціях ґрунтуються титриметричні методи ацидиметрії і алкаліметрії?
а) на реакціях нейтралізації кислот, фенолів, амінів, амінокислот, основ.
б) на реакціях осадження в певному середовищі (рН);
в) на окисно-відновних реакціях за участю окисників і відновників.
1.5.20. Які класи речовини можна визначити методом ацидиметрії?
а) кислоти і солі; б) солі і основи;
в) кислоти і основи.
1.5.21. Які класи речовин можна визначити методом алкаліметрії?
а) кислоти і солі; б) солі і основи;
в) кислоти і основи.
1.5.22. Чи можна розрахувати молярну концентрацію еквіваленту речовини в розчині за результатами титриметричного (об’ємного) аналізу?
а) так; б) ні;
в) тільки за масою наважки.
1.5.23. Чи можливо за точною наважкою КОН приготувати «стандартний розчин» для титриметричного аналізу?
а) так; б) ні; в) після попередньої очистки.
1.5.24. Ацидиметрія – це метод визначення вмісту:
а) основ у розчині титруванням стандартним розчином кислот;
б) багатоосновних кислот у розчині титруванням розчином натрій гідроксиду;
в) кислот у розчині титруванням стандартним розчином основ;
г) гідросульфітів у розчині титруванням стандартним розчином натрій гідроксиду.
1.5.25. В методі ацидометрії робочим розчином є розчин з точно відомою концентрацією:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.26. Методом ацидометрії можна визначити концентрацію:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.27. В методі алкаліметрії робочим розчином є розчин з точно відомою концентрацією:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.28. Методом алкаліметрії можна визначити концентрацію:
а) лугу; б) кислоти;
в) солі; г) води.
1.5.29. Розчин якої речовини використовується як титрант при алкаліметричному визначенні:
а) натрій гідроксиду; б) хлоридної кислоти;
в) натрій хлориду; г) сульфітної кислоти.
1.5.29. Кислотність шлункового соку визначають у клінічних одиницях (к.о.), які виражаються об’ємом:
а) 0,1М розчину лугу, що пішов на титрування 100см3 профільтрованого шлункового соку;
б) 0,1М розчину кислоти, що пішов на титрування 100см3 профільтрованого шлункового соку;
в) 0,01М розчину лугу, що пішов на титрування 100см3 профільтрованого шлункового соку;
г) 0,01М розчину кислоти, що пішов на титрування 100см3 профільтрованого шлункового соку.
1.5.30. Загальна кислотність є:
а) вищою за вільну кислотність;
б) нищою за вільну кислотність;
в) рівною вільній кислотністі;
г) нищою за зв’язану кислотність.
1.5.31. Чому дорівнює молярна маса еквівалента сульфатної кислоти у реакції з натрій гідроксидом:
а) 49 г/моль; б) 98 г/моль;
в) 196 г/моль; г) 49 г.
1.5.32. Чому дорівнює молярна маса еквівалента хлоридної кислоти у реакції з кальцій гідроксидом:
а) 36,5 г/моль; б) 18,25 г/моль;
в) 36 г; г) 73 г/моль.
1.5.33. Чому дорівнює молярна маса еквівалента натрій гідроксиду у реакції з сульфатною кислотою:
а) 20 г/моль; б) 40 г/моль;
в) 40 г; г) 80 г/моль.
1.5.34. Молярна маса еквіваленту Al2(SO4)3 складає (г/моль):
а) 171; б) 114; в) 57; г) 342.
1.5.35. Чому дорівнює молярна маса еквівалента аміаку у реакції з хлоридною кислотою :
а) 17 г/моль; б) 34 г/моль;
в) 2 моль; г) 14 г/моль.
1.5.36. Вкажіть фактор еквівалентності fекв. оксалатної кислоти у реакції:
Н2С2О4 + 2NaOH = Na2С2О4 + 2Н2О
а) ½; б) 1; в) 1/3; г) ¼.
1.5.37. Вкажіть фактор еквівалентності fекв. натрій гідроксиду у реакції:
Н2С2О4 + 2NaOH = NaС2О4 + 2Н2О
а) ½; б) 1; в) 1/3; г) ¼.
1.5.38. Вкажіть фактор еквівалентності fекв. сульфатної кислотиу реакції з амоній гідроксидом:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.39. Вкажіть фактор еквівалентності fекв. амоній гідроксиду у реакції з хлоридною кислотою:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.40. Вкажіть фактор еквівалентності fекв. кальцій гідроксиду у реакції з сульфатною кислотою:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.41. Вкажіть фактор еквівалентності fекв. ацетатної кислотиу реакції з барій гідроксидом:
а) ½; б) 1; в) 1/3; г) ¼.
1.5.42. Вкажіть фактор еквівалентності fекв. барій гідроксиду у реакції з оксалатною кислотою:
Н2С2О4 + Вa(OH)2 = ВaС2О4 + 2Н2О
а) ½; б) 1; в) 1/3; г) ¼.
1.5.43. Тимчасова твердість води обумовлена наявністю в ній солей:
а) Na2CO3 і CaCO3; б) Ca(HCO3)2 і MgSO4;
в) Ca(HCO3)2 Mg(HCO3)2.
1.5.44. Постійна твердість води обумовлена наявністю в ній солей:
а) CaCl2, MgSO4; б) CaCO3, MgCO3;
в) MgSO4, CaCO3
1.5.45. Вода вважається твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.46. Вода вважається м’якою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.47. Вода вважається нормальної твердості, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.48. Вода вважається дуже твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.49 В яких одиницях вимірюють твердість води:
а) г/л; б) кг/л; в) ммоль-екв/л; г) моль/л.
1.5.50. Вода вважається твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.51. Вода вважається м’якою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.52. Вода вважається нормальної твердості, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.53. Вода вважається дуже твердою, якщо концентрація йонів Ca2+, Mg2+ відповідає значеннями
а) до 4 ммоль-екв/л; б) 4-7 ммоль-екв/л;
в) 7-12 ммоль-екв/л; г) > 12 ммоль-екв/л.
1.5.54 В яких одиницях вимірюють твердість води:
а) г/л; б) кг/л; в) ммоль-екв/л; г) моль/л.
1.5.55. Одним з показників якості води, що використовується у фармацевтичній промисловості, є її твердість. Яка з наведених солей може зумовлювати постійну твердість води?
*а) MgCl2; б) KCl;
в) Ca(HCO3)2; г) Mg(HCO3)2
1.5.56. У фармацевтичному аналізі, в якості титранту використовують 0,1 М розчин хлоридної кислоти. Який об'єм цієї кислоти можна приготувати виходячи з 100 мл 0,5 М розчину HCl?
*а) 500мл; б) 50 мл;
в) 200 мл ; г) 1000 мл .
1.5.57. Титриметричний метод аналізу – це метод:
а) кількісного аналізу кислот, основ, солей;
б) кількісного аналізу досліджуваного розчину в процесі титрування;
в) якісного аналізу кислот, основ, солей в процесі титрування.
1.5.58. Процес титрування – це:
а) повільне додавання одного розчину до іншого;
б) повільне додавання одного розчину до іншого до настання еквівалентної
точки;
в) повільне додавання одного розчину до води.
1.5.59. Вимоги, до реакцій в титриметричному аналізі:
а) повинні проходити швидко, кількісно, не бути зворотніми; можливість встановлення еквівалентної точки;
б) повинні проходити швидко, кількісно, бути зворотніми;
в) повинні проходити повільно, кількісно, не бути зворотніми, можливість встановлення еквівалентної кількості.
1.5.60. Точну концентрацію за даними титрування розраховують за формулою:
а)  ; б)
; б)  ;
;
в) 
1.5.61. Для приготування титрованих розчинів використовують:
а) мірний циліндр; б) мірну колбу;
в) мірний хімічний стакан; г) піпетку.
1.5.62. Який хімічний посуд використовують для відбору проби для титрування:
а) мірна колба; б) піпетка;
в) бюретка; г) стакан.
1.5.63. Забарвлення метилоранжу в кислому середовищі:
а) рожевий; б) жовтий;
в) безбарвний.
1.5.64. Забарвлення метилоранжу в лужному середовищі
а) рожевий; б) жовтий;
в) безбарвний.
1.5.65. Інтервал переходу забарвлення метилоранжу:
а) 3,1-4,4; б) 8,2-10,0;
в) 4,0-10,0.
1.5.66. Фенолфталеїн в кислому середовищі:
а) рожевий; б) малиновий;
в) безбарвний.
1.5.67. Фенолфталеїн в лужному середовищі має забарвлення:
а) рожеве; б) малинове; в) безбарвний.
1.5.68. Інтервал переходу забарвлення індикатора фенолфталеїна:
а) 3,1-4,4; б) 3,1-8,2; в) 8,2-10,0.
1.5.69. Яка реакція лежить в основі кислотно-основного титрування:
а) окиснення; б) осадження; в) нейтралізації.
1.5.70. Основне рівняння методу нейтралізації:
а) [Н+] + [ОН−] = Н2О; б) Н+ + ОН− = Н2О; в) [Н+] + [ОН−] = 10−14.
1.5.71. Робочі розчини в методі нейтралізації:
а) Н2С2О4⋅2Н2О, Н2SO4, NaOH, KOH;
б) Н2SO4, HCl, Na2CO3, NaOH;
в) NaOH, KOH, Н2SO4, HCl.
1.5.72. Методом нейтралізації можна визначати:
а) кислоти, відновники;
б) кислоти, основи, солі, які не піддаються гідролізу;
в) кислоти, основи, солі, які піддаються гідролізу.
1.5.73. Класи сполук, які визначаються методом кислотно-основного титрування:
а) кислоти, основи, окисники;
б) кислоти, основи, солі, які не піддаються гідролізу;
в) кислоти, основи, солі, які піддаються гідролізу.
1.5.74. Криві титрування – це:
а) зміна забарвлення розчину в процесі титрування;
б) графічне зображення зміни реакції середовища в процесі титрування;
в) зміна об’єму розчинів в процесі титрування.
1.5.75. Криві титрування показують:
а) зміну об’ємів розчинів при титруванні;
б) залежність рН системи від зміни об’єму титрованого розчину;
в) графічне зображення зміни індикатора.
1.5.76. Стрибок титрування – це:
а) різка зміна рН під час титрування; б) різка зміна рН поблизу еквівалентної точки;
в) момент кінця реакції.
1.5.77. Еквівалентна точка – це:
а) точка кінця реакції;
б) рН, за якого сполуки прореагували в рівних кількостях;
в) рН, за якого сполуки прореагували в еквівалентних кількостях.
1.5.78. Основне рівняння методу ацидіметрії:
а) [Н+] / [ОН−] = Н2О; б) Н+ + ОН− = Н2О; в) [Н+] + [ОН−] = 10−14.