 |
|
КИСЛОТНО-ОСНОВНІ РІВНОВАГИ. рН.
1.6.1. Які з перелічених груп речовин відносять тільки до елекролітів:
а) NaCl, CaCl2, KOH;
б) KOH, C2H5OH, NaCl;
в) Na2B4O7 10H2O, HCOOH, NaCl.
г) C6H12O6, C2H5OH, H2SO4.
1.6. 2. Які з перелічених груп речовин відносять тільки до неелектролітів:
а) C6H12O6 , C2H5OH;
б), KCl, C2H5OH;
в) NaCl H2SO4;
г) С12Н22О11, СН3СНСООН.
1.6. 3. Які із наведених речовин відносять до слабких електролітів?
а) NaCl, б) CH3COOH;
в) Na2SO4; г) HCl.
1.6.4. Які із наведених речовин відносять до слабких електролітів?
а) Н2О, б) NaCl;
в) HCl; г)CCl3COOH.
1.6.5. Які із наведених речовин відносять до слабких електролітів?
а) C2H5OH, б) CCl3COOH;
в) NaCl; г) H2SO4.
1.6.6. Які із наведених речовин відносять до cильних електролітів?
а) NaCl; б) BaSO4;
в) Ca3(PO4)2; г) H2O.
1.6.7. Які із наведених речовин відносять до cильних електролітів?
а) BaSO4; б) H2O;
в) MgCl2; г) H2O.
1.6.8. Які із наведених речовин відносять до cильних електролітів?
а) CaCl2; б) CaCO3;
в) Ca3(PO4)2; г) AgCl.
1.6.9. Згідно з теорією Бренстеда і Лоурі основами є речовини, які при перебігу даної реакції можуть бути:
а) донорами гідроксидних груп;
б) донорами протонів (іонів гідрогену);
в) акцепторами протонів;
г) акцепторами електронної пари.
1.6.10. Згідно з теорією Бренстеда і Лоурі основами є речовини, які при перебігу даної реакції можуть бути:
а) донорами гідроксидних груп;
б) донорами протонів (йонів гідрогену);
в) акцепторами протонів;
г) акцепторами електронної пари.
1.6.11. Водневий показник записується як вираз:
а) [H+]; б) [OH-]; в) pH; г) pOH.
1.6.12. Як записати йонний добуток води?
а) [H3O+]*[OH-]=10-14 б) 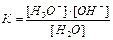
в) 
 г)
г) 
1.6.13. Яка формула використовується для розрахунку рН розбавленого розчину HCl?
а) рН = -ℓg[Н+]; б) рН = 14 – рОН;
в) рН = - ℓgСОН- г) рН = -ℓg[Н+]∙2
1.6.14. Закон розведення Оствальда можна виразити:
а) 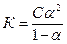 б)
б) 
в) Р=СRT; г) рН=14-рОН
1.6.15. Яке значення рН в кислих розчинах?
а) рН=0-5; б) рН>7; в) рН=5-7; г) рН<7.
1.6.16. Яке значення рН в лужних розчинах?
а) рН=0-5; б) рН>7; в) рН=5-7; г) рН<7.
1.6.17. Ступінь дисоціації (α) для слабких електролітів при с (електроліту) = 0,1 моль/л за температури 250С має значення:
а) α=0; б) α<1; в) α<0,1; г) α<0,03.
1.6.18. Що таке ацидоз?
а) зміщення рН середовища в організмі у лужну сторону;
б) розрідження крові внаслідок плазмолізу;
в) зміщення рН середовища в організмі у кислу сторону;
г) підвищене згортання крові.
1.6.19. Що таке алкалоз?
а) зміщення рН середовища в організмі у лужну сторону;
б) підвищення чутливості організму до окремих ліків;
в) підвищення згортання крові;
г) нервове збудження.
1.6.20. Ацидоз – це відхилення рН крові до:
а) 8,3; б) 8,0; в) 7,2; г) 7,5.
1.6.21 Алкалоз – це відхилення рН крові до:
а) 6,5; б) 6,8; в) 7,1; г) 7,5.
1.6.22. Зрушення кислотно-основного стану крові у сторону підвищення концентрації йонів водню (зниження рН) і зменшення резервної лужності називають:
а) анабіозом; б) алкалозом;
в) ацидозом; г) антагонізмом.
1.6.23. Зрушення кислотно-основного стану крові у сторону зменшення концентрації йонів водню (підвищення рН) і збільшення резервної лужності називається:
а) анабіозом; б) ацидозом;
в) алкалозом; г) антагонізмом.
1.6.24. Вибрати рівняння гідролізу соди і рН середовища в розчині
а) H2SO4 + NaOH → рН=7
б) HCl + Na2CO3 → рН<7
в) H2CO3 + NaOH → рН<7
г) H2O + Na2CO3 → рН>7
1.6.25. Міра активної кислотності середовища:
а) ступінь дисоціації;
б) константа дисоціації;
в) рН розчину;
г) об’єм 0,1 М розчину NaOH, затраченого на титрування.
1.6.26. Що таке активна кислотність?
а) ступінь дисоціації кислоти;
б) концентрація йонів Н+ в розчині;
в) константа дисоціації кислоти;
г) відтитрована кислотність середовища.
1.6.27. Інтервал рН, що відповідає поняттю «підвищена» кислотність шлункового соку:
а) рН=0,9; б) рН<1,9; в) рН<4,5; г) рН=7.
1.6.28. Чи одинакові активна і загальна кислотність у розчині сульфатної кислоти
а) так, б) ні, активна більша;
в) ні, загальна більша; г) ні, активна менша.
1.6.29. Чи одинакова активна і загальна кислотність у розчині HCl?
а) ні; б) більша активна;
в) так; г) більша загальна.
1.6.30. Чи однакові активна і загальна кислотність у розчині оцтової кислоти?
а) загальна менша; б) активна менша;
в) активна набагато більша; г) так.
1.6.31. Імовірне значення рН крові людини в нормі:
а) рН=7; б) рН=7,2;
в) рН=7,36; г) рН=7,56.
1.6.32. Яке порушення кислотно-лужної рівноваги може наступити, якщо рН плазми крові стане 7,55?
а) кислотність зросте; б) наступить алкалоз;
в) наступить ацидоз; г) відбудеться плазмоліз.
1.6.33. Імовірні границі зміни значення рН слини:
а) 6,5-7,5; б) 5.6-7,9;
в) 6,0-8,6 г) 7,0-8,6.
1.6.34. Значення рН сечі людини знаходиться в межах:
а) 4,8 – 5,8; б) 6,5 – 8,5;
в) 2,2 – 5,0; г) 5,0 – 6,5.
1.6.35. Фізіологічне значення рН сечі:
а) 1-3; б) 3-6; в) 5-8; г) 6-9.
1.6.36. Можливі границі зміни рН сльозової рідини:
а) 7,6-7,8; б) 7,0-7,6;
в) 7,7-8,7 г) 8,0-8,7.
1.6.37. Чому дорівнює в середньому рН слини в нормі:
а) 5,0; б) 6,75; в) 7,75; г) 8,25.
1.6.38. Імовірне значення рН шлункового соку в нормі:
а) 0,6; б) 1,05; в) 1,65; г) 2,05.
1.6.39. Інтервал рН, що відповідає поняттю «знижена» кислотність шлункового соку:
а) рН > 7,36; б) рН > 0,9;
в) рН > 1,65; г) рН > 2,0.
1.6.40. Інтервал рН, що відповідає поняттю «нульова» кислотність шлункового соку:
а) рН > 7; б) рН >1,65;
в) рН > 1,0; г) рН > 2,0.
1.6.41. Концентрація йонів гідроксилу 0,0001 моль/л. Яке рН розчину?
а) 10; б) 9; в) 4; г) 5.
1.6.42. Концентрація йонів водню в розчині Сн+= 0,001 моль/л. Підрахувати рН розчину.
а) рН=0,0001; б) рН=0,1;
в) рН=2; г) рН=3.
1.6.43. Знайти концентрацію ОН-йонів у морській воді, якщо її рН = 8,0.
а) [ОН-] = 1*10-8 б) [ОН-] = 1*10-6;
в) [ОН-] = 1*10-4; г) [ОН-] = 1*10-2.
1.6.44. Розрахувати концентрацію йонів водню у розчині сульфатної кислоти, якщо рН = 2. Навести розрахунки.
а) [H+] = 0,1; б) [H+] = 0,01;
в) [H+] = 0,2; г) [H+] = 0,02.
1.6.45. Визначити концентрацію йонів водню в слині, якщо рН=6,0. Навести розрахунок.
а) [H+] = 6,0; б) [H+] = 106;
в) [H+] = 10-6; г) [H+] = 1*106.
1.6.46. Розрахувати концентрацію [ОН-]-йонів у питній воді, якщо її рН = 6. Навести розрахунки.
а) [ОН-] = 0,003; б) [ОН-] = 1*10-6;
в) [ОН-] = 1*10-8; г) [ОН-] = 0,6.
1.6.47. Після тривалої роботи в гарячому цеху у робочого відмічено підвищення температури тіла до 38,5°С, тахікардія, порушення ритму сердечних скорочень. Переважно втрата якого електроліту призводить до порушення роботи серця?
а) калію; б) кальцію;
в) магнію; г) фосфору.
1.6.48. Ступінь дисоціації аміаку збільшується при:
а) Розведенні розчину;
б) Охолодженні розчину;
в) Концентруванні розчину;
г) Додаванні солі амонію;
1.6.49. Водневий показник 0,01 М розчину HCl дорівнює:
а) 2; б) 3; в) 5; г)4.
1.6.50. Водневий показник 0,001 Н розчину KOH дорівнює:
а) 11; б) 13; в) 10; г) 12
1.6.51. Водневий показник 0,01 Н розчину слабкої одноосновної кислоти (ступінь дисоціації 1\%) дорівнює:
а) 4; б) 2; в) 1; г) 3
1.6.52. Водневий показник 0,001 М слабкої однокислотної основи (ступінь дисоціації 1\%) дорівнює:
а) 9; б) 8; в) 10 г) 13
1.6.53. Водневий показник 0,05 М розчину H2SO4 дорівнює:
а) 1; б) 2; в) 5; г) 4
1.6.54. Водневий показник 0,001 М розчину хлоридної кислоти дорівнює:
а) 3; б) 0; в) 10; г) 7
1.6.55. Іонний добуток води – це:
а) сума концентрацій протонів та гідроксид-іонів;
б) добуток концентрацій протонів та гідроксид-іонів;
в) відношення концентрацій протонів та гідроксид-іонів.
1.6.56. За рН = 2 іонний добуток води дорівнює:
а) 10-2 моль/л; б) 10-14 моль/ л;
в) 10-12моль/л.
1.6.57. За рН = 11 іонний добуток води дорівнює:
а) 10-2 моль/л; б) 10-11 моль/ л;
в) 10-14 моль/л.
1.6.58. .Активна кислотність – це:
а) концентрація кислоти;
б) концентрація кислотного залишку;
в) концентрація протонів.
г) концентрація гідроксидних йонів
1.6.59. Потенціальна кислотність – це:
а) концентрація непродисоційованих молекул кислоти;
б) концентрація кислоти;
в) концентрація іонів гідрогену.
1.6.60. Загальна кислотність – це:
а) концентрація непродисоційованих молекул кислоти;
б) загальна концентрація кислоти;
в) концентрація протонів.
1.6.61. Титруванням визначають:
а) активну кислотність; б) потенціальну кислотність; в) загальну кислотність.
1.6.62. Формула обчислення рН розчину сильної кислоти:
а) рН = – lg Кд [кислоти]; б) рН = – lg [кислоти]; в) рН = – lgα – [кислоти].
1.6.63.Формула обчислення рН розчину слабкої кислоти:
а) pH =−lg Кд ⋅[кислоти] ;
б) рН = – lg [кислоти];
в) рН = – lg К д · [кислоти].
1.6.64.рОН – це:
а) натуральний логарифм концентрації лугу.
б) від’ємний десятковий логарифм концентрації гідроксид–іонів;
в) від’ємний десятковий логарифм концентрації основи.
1.6.65. Пепсин шлункового соку діє у:
а) кислому середовищі; б) лужному середовищі; в) нейтральному середовищі.
1.6.66 .рН венозної крові:
а) більший за рН артеріальної крові;
б) менший за рН артеріальної крові;
в) однаковий із рН артеріальної крові.
1.6.67. рН в клітині:
а) менший за рН крові; б) більший за рН крові; в) однаковий із рН крові.
1.6.68. .рН 0,001 М NaOH становить:
а) 3; б) 11; в) 6.
1.6.69. рОН 0,01М розчину КОН:
а) 12; б) 2; в) 7.
ГІДРОЛІЗ СОЛЕЙ
1.7.1. Гідроліз солі – це реакція взаємодії солі з водою, в результаті якої:
а) порушується рівновага дисоціації води, утворюється слабкий електроліт і, як правило, змінюється кислотність середовища;
б) утворюються сильні електроліти, змінюється кислотність середовища;
в) кислотність середовища не змінюється, утворюються сильні електроліти;
г) не порушується рівновага дисоціації води;
д) утворюється газ або осад, не змінюється кислотність середовища.
1.7.2. Посилення гідролізу солей при підвищенні температури пояснюється:
а) збільшенням швидкості ендотермічної реакції дисоціації води;
б) зменшенням швидкості ендотермічної реакції дисоціації води;
в) зменшенням швидкості екзотермічної реакції дисоціації води;
г) додавання СН3СООН;
д) збільшенням швидкості екзотермічної реакції дисоціації води.
1.7.3. Константа гідролізу (Кr) солі слабкої кислоти і сильної основи або слабкої основи і сильної кислоти – це відношення іонного добутку води (Кв) до:
а) константи дисоціації слабкого електроліту;
б) суми молярних концентрацій іонів гідрогену та гідроксиду;
в) добутку молярних концентрацій іонів гідрогену та гідроксиду;
г) кількості речовин солі, що прогідролізувала;
д) кількості речовин солі, що продесоціювала.
1.7.4. Ступінь гідролізу солі (αr) – це відношення до загальної кількості речовини розчиненої солі:
а) молярної концентрації солі;
б) масової концентрації солі;
в) масової частки солі;
г) кількості речовин солі, що прогідролізувала;
д) кількості речовин солі, що продесоціювала.
1.7.5. Ступінь гідролізу солі (αr) зростає при:
а) збільшенні концентрації солі;
б) зниженні температури;
в) зниженні температури та збільшенні концентрації солі;
г)зменшенні концентрації солі;
д) додаванні солі, утвореної сильною кислотою та лугом.
1.7.6. Вказати, яка дія змістить рівновагу гідролізу натрій ацетату вліво:
а) підвищення температури;
б) додавання натрій ацетату;
в) додавання води;
г) додавання СН3СООН;
д) додаванні солі, утвореної сильною кислотою та лугом.
1.7.7. Гідролізу не підлягають солі, утворені:
а) слабкою кислотою та сильною основою (лугом);
б) слабкою основою та сильною кислотою;
в) сильною кислотою та сильною основою (лугом);
г) слабкою кислотою та слабкою основою;
д) кислим залишком та катіоном металу.
1.7.8. Назвати водний розчин електроліту, що має найменше значення рН:
а) NaCl; б) KCl; в) CaCl2;
г) NH4Cl; д) BaCl2.
1.7.9. Із наведених нижче солей виберіть ту, що зазнає гідролізу:
а) ферум (ІІІ) нітрат; б) барій хлорид;
в) аргентум бромід; г) калій нітрат;
д) натрій сульфат.
1.7.10. Із наведених нижче солей виберіть ту, що зазнає гідролізу:
а) ферум (ІІ) хлорид; б) барій хлорид;
в) аргентум хлорид; г) калій хлорид;
д) натрій хлорид.
1.7.11. Із наведених нижче солей виберіть ту, водний розчин якої слабкокислий:
а) хром (ІІІ) сульфат; б) барій хлорат;
в) натрій карбонат; г) натрій хлорат;
д) калій перхлорат.
1.7.12. Із наведених нижче солей виберіть ту, водний розчин якої слабколужний:
а) калій нітрат; б) калій сульфат;
в) калій хлорат; г) калій сульфід;
д) калій бромід.
1.7.13. Із наведених нижче солей виберіть ту, водний розчин якої слабколужний:
а) калій сульфат; б) калій сульфіт;
в) аргентум нітрат; г) барій сульфат;
д) натрій хлорид.
1.7.14. Із наведених нижче солей виберіть ту, водний розчин якої лужний:
а) натрій сульфат; б) натрій ціанід;
в) аргентум нітрат; г) натрій нітрат;
д) натрій бромід.
1.7.15. Яка із наведених солей не гідролізує:
а) AlPO4; б) AlCl3; в) Al2(SO4)3;
г) Al(NO3)3; д) Al2S3.
1.7.16. Яка реакція середовища сечі, якщо аналізи показали, що в ній містяться такі солі: NH4Cl, NH4Н2PO4, (NH4)2SO4:
а) кисла; б) лужна; в) нейтральна;
г) слабколужна; д) слабкокисла.
1.7.17. Реакція середовища при гідролізі солі, утвореної слабкою кислотою та сильною основою (лугом), буде:
а) нейтральна; б) слабкокисла;
в) кисла; г) лужна; д) слабколужна.
1.7.18. Реакція середовища при гідролізі солі, утвореної слабкою основою та слабкою кислотою, якщо Кд(основи)> Кд(кислоти) буде:
а) лужна; б) нейтральна; в) кисла
г) слабколужна; д)слабкокисла.
1.7.19. Реакція середовища при гідролізі солі, утвореної слабкою основою та слабкою кислотою, якщо Кд(основи)< Кд(кислоти) буде:
а) лужна; б) нейтральна; в) кисла;
г) слабкокисла; д) слабколужна.
1.7.20. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою кислотою та лугом:
а) рН<7; б) рН≈7; в) рН=7;
г) рН>7; д) рН=0.
1.7.21. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою основою та сильною кислотою:
а) рН<7; б) рН≈7; в) рН=7;
г) рН>7; д) рН=0.
1.7.22. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою кислотою та слабкою основою, якщо Кд(основи)> Кд(кислоти):
а) рН<7; б) рН≈7; в) рН=7;
г) рН>7; д) рН=0.
1.7.23. Яке значення рН матиме розчин при гідролізі солі, утвореної слабкою кислотою та слабкою основою, якщо Кд(основи)= Кд(кислоти):
а) рН<7; б) рН≈7; в) рН=7;
г) рН>7; д) рН=0.
1.7.24. Вкажіть, яка із наведених солей підлягає повному незворотньому гідролізу:
а) Cr2S3 ; б) Al2(SO4)3;
в) Cr(NO3)3; г) KNO3
1.7.25. Яка із наведених солей внаслідок зворотнього гідролізу дає лужне середовище?
а) Na2CO3; б) KCl;
в) AlCl3; г) NaNO3
1.7.25. Яка із наведених солей внаслідок зворотнього гідролізу дає кисле середовище?
а) Fe(NO3)3; б) K2CO3;
в) NaI; г) K3PO4.
1.7.26. Який із наведених оксидів є ангідридом нітратної кислоти?
а) N2O5; б) N2O3;
в) NO2; г) NO.
1.7.27. Вкажіть колір лакмусу у розчині нітрату заліза (III):
а) червоний; б) Фіолетовий;
в) Синій; г) Малиновий
1.7.28. Вкажіть колір лакмусу у розчині карбонату натрію:
а) синій; б) Фіолетовий;
в) Червоний ; г) Малиновий .
1.7.29. Вкажіть колір метилоранжу в розчині сульфату цинку:
а) рожевий; б) Жовтий;
в) Оранжевий ; г) Червоний
1.7.30. Вкажіть колір метилоранжу в розчині карбонату калію:
а) жовтий; б) Оранжевий;
в) Рожевий; г) Безбарвний
1.7.30. Вкажіть колір фенолфталеїну у розчині хлориду алюмінію:
а) безбарвний ; б) Малиновий;
в) Жовтий; г) Синій
1.7.31. Вкажіть колір фенолфталеіну в розчині ортофосфату калію:
а) малиновий; б) Безбарвний
в) Червоний ; в) Синій
1.7.32. Вкажіть колір метилового червоного у розчині сульфату хрому (III):
а) червоний; б) Жовтий ;
в) Синій; в) Безбарвний
1.7.33. Вкажіть, яка із вказаних солей не піддається гідролізу:
а) Ba(NO3)2 ; б) ZnCl2
в) KNO2 ; г) K2HPO4
1.7.34. При розчиненні у воді якої із солей амонію, середовище залишиться практично нейтральним?
а) CH3COO NH4 ; б) (NH4)2SO4;
в) NH4Cl; г) NH4NO3.
1.7.35. Виходячи зі значень добутків розчинності [ДР], вкажіть, у якій з реакцій можно повно осадити катіони Ca2+ з розчину
а) Ca2+ + 2F- = CaF2 ДР [CaF2] = 4,0·10 -11;
б) Ca2+ + SO42- = CaSO4 ДР [CaF2] = 9,1·10 -8
в) Ca2+ + CO32- = CaCO3 ДР [CaCO3] = 4,8·10 -9
г) Ca2+ + C2O42- = CaC2O4 ДР [CaC2O4] = 3,8·10-9
1.7.36. Яка з наведених солей не піддається гідролізу
а) K2SO4; б) K2SO3;
в) AlBr3 ; г) CuSO4
1.7.37. Гідроліз яких солей перебігає в одну стадію без зворотності процесу
а) Cr2S3; б) Na2S;
в) CuS; г) AlCl3
нічого з переліченого
1.7.38. Вкажіть сіль, розчин якої має лужну реакцію:
а) Na2S; б) Na2SO4;
в) KCl; г) CuCl2.
1.7.39. Додавання якої речовини зменшить ступінь гідролізу солі CuSO4?
а) H2SO4; б) H2O;
в) KOH; г) Na2CO3.
1.7.40. Із перелічених нижче нітратів гідролізу піддається:
а) NH4NO3 ; б) Sr(NO3)2
в) NaNO3 ; г) KNO3
1.7.41. Серед наведених сполук вкажіть сіль, водний розчин якої має кисле середовище:
а) ZnSO4; б) Na2B4O7;
в) Na3PO4; г) NaCl
БУФЕРНІ РОЗЧИНИ
1.8.1. Характерною властивістю буферних систем є:
а) постійність величини рН при розведенні або при додаванні невеликої кількості кислоти чи лугу;
б) незначна зміна значення рН при додаванні невеликої кількості кислоти;
в) зміна значення рН при розведенні;
г) незначна зміна рН додаванні невеликої кількості лугу.
1.8.2. Як впливає розведення буферних систем на значення рН:
а) не впливає; б) майже не змінює;
в) змінює значення рН в сторону кислого середовища;
г) змінює значення рН в сторону лужного середовища.
1.8.3. Величина рН буферних систем залежить:
а) від константи дисоціації слабкого електроліту і від співвідношення компонентів;
б) від співвідношення компонентів і температури;
в). від константи іонізації і не залежить від співвідношення компонентів;
г) від константи дисоціації і не залежить від тиску.
1.8.4. Для розрахунку рН буферного розчину необхідно знати:
а) константу дисоціації і співвідношення кислота: сіль:
б) тиск і температуру;
в) константу дисоціації і температуру;
г) співвідношення співвідношення кислота : сіль і тиск розчину.
1.8.5. рН кислотного буферу залежить від:
а) співвідношення компонентів; б) тиску;
в) температури; г) часу.
1.8.6. рН основного буферу залежить від:
а) природи речовин; б) тиску;
в) температури; г) часу.
1.8.7. Серед написаних сумішей виберіть ті, що мають буферну дію:
а) H2CO3; KHCO3; б) HNO3; NH4NO3;
в) H2CO3; NH4Cl; г) NH4OH; NaH2PO4.
1.8.8.Серед написаних сумішей виберіть ті, що мають буферну дію:
а) H2CO3; NH4Cl; б) HNO3; NH4NO3;
в) Na2HPO4; H3PO4; г)CH3COOH; CH3COONa.
1.8.9. Кислотним буфером є суміш:
а) СН3СООН і СН3СООNa б) NH4Cl і NH4OH;
в) Na2HPO4 і NaH2PO4; г) Na2CO3 і NaHCO3.
1.8.10. Основним буфером є суміш:
а) СН3СООН і СН3СООNa б) NH4Cl і NH4OH;
в) Na2HPO4 і NaH2PO4; г) Na2CO3 і NaHCO3.
1.8.11. Ацетатна буферна система представлена рівнянням:
а) СН3СООН + СН3СООNa
б) CH3COOH + NaSO4
в) CH3COOH + NaOH г) HCl + CH3COONa
1.8.12. Гідрокарбонатна буферна система представлена рівнянням:
а) H2CO3 + NaCl; б) H2CO3 + Na2CO3;
в) H2CO3 + NaHCO3; г) HCl + NaOH.
1.8.13. Ацетатний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 3,7 – 5,6; б) 6,2 – 8,2;
в) 1,3 – 3,4; г) 5,8 – 6,9.
1.8.14. Амонійний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 8,4 – 10,3; б) 5,4 – 6,8;
в) 6,8 – 8,3; г) 4,1 – 5,6.
1.8.15. Фосфатний буферний розчин в залежності від співвідношення кислоти і солі може існувати в діапазоні рН:
а) 5,9 – 8,0; б) 4,8 – 7,2;
в) 8,1 – 9,5; г) 3,2 – 5,8.
1.8.16. Яка із фосфатних буферних систем, що складається із 0,02 молярних розчинів Na2HPO4 i NaH2PO4 , поданих нище, має значення рН=6,81:
а) 40 мл Na2HPO4 та 40 мл NaH2PO4;
б) 10 мл Na2HPO4 та 20 мл NaH2PO4;
в) 20 мл Na2HPO4 та 30 мл NaH2PO4;
г) 25 мл Na2HPO4 та 40 мл NaH2PO4.
1.8.17. Ацетатна буферна система, яка відповідає значенню рН=4,65 складається з 0,01 молярних розчинів СН3СООН і СН3СООNa, які подані у об’ємах:
а) 20 мл СН3СООН та 20 мл СН3СООNa; б) 10 мл СН3СООН та 25 мл СН3СООNa;
в) 30 мл СН3СООН та 15 мл СН3СООNa; г) 20 мл СН3СООН та 10 мл СН3СООNa.
1.8.19 При якому співвідношенні кислота : сіль рН кислотної буферної системи найбільший:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.20. При якому співвідношенні кислота : сіль рН кислотної буферної системи найменший:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.21. При якому співвідношенні кислота : сіль рН аміачної буферної системи буде найбільша:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.22. При якому співвідношенні кислота : сіль рН аміачної буферної системи буде найменша:
а) 1:9; б) 2:8; в) 5:5; г) 9:1.
1.8.23. Наведіть приклади буферних розчинів утворених слабкою основою і її сіллю.
1.8.24. Наведіть приклади буферних розчинів, що містять солі багато основних слабких кислот.
1.8.25. Наведіть приклади буферних розчинів утворених солями багато основних слабких кислот.
1.8.26. Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти чи лугу:
а) електролітична дисоціація, протоліз, нейтралізація;
б) електролітична дисоціація, протоліз, гідроліз;
в) гідроліз, протоліз, нейтралізація;
г) окислення, гідроліз, протоліз.
1.8.27. Механізм дії буферних систем направлений на:
а) відновлення кислих і лужних продуктів;
б) окиснення кислих і лужних речовин;
в) нейтралізацію кислих і лужних продуктів;
г) гідроліз кислих і лужних продуктів.
1.8.28. Механізм дії на ацетатну буферну систему кислотою представлений в рівнянні:
а) СН3СОО- + Н3О+ ↔ СН3СООН + Н2О;
б) NН3∙H2O + H3O+ ↔ NH4+ + 2H2O;
в) H3O+ + HCO3- ↔ H2CO3 + H2O;
г) H3O+ + OH- ↔ 2H2O.
1.8.29. Механізм дії на амонійну буферну систему лугу представлений рівнянням:
а) OH- + H3O+ ↔ 2H2O;
б) NН3 ∙ H2O + H3O+ ↔ NH4+ + 2H2O;
в) OH- + HCO3- ↔ HCO3- + H2O
г) OH- + NH4+ ↔ NH3 ∙ H2O.
1.8.30. Механізм дії на гідрокарбонатну буферну системукислотою представлений в рівнянні:
а) Нb- + H3O+↔HHb + H2O;
б) H3O+ + OH- ↔ 2H2O;
в) HPO4-2 + H3O+ ↔ H2PO4- + H2O;
г) H3O+ + HCO3- ↔ H2CO3 + H2O.
1.8.31. Механізм дії на гідрокарбонатну буферну систему кислотою представлений рівнянням:
а) H3O+ + HCO3- ↔ H2CO3 + H2O;
б) НСО-3 + OH- ↔ H2CO3
в) H2CO3 + OH- ↔ HCO-3 + H2O
г) H3O+ + OH- ↔ 2H2O.
1.8.32. Механізм дії на фосфатну буферну систему кислотою представлений:
а) НРО4-2 + Н3О+ ↔ Н2РО4- + Н2О
б) НРО4- + Н3О+ ↔ Н3РО4- + ОН-
в) Н2РО4- + ОН- ↔ НРО4-2 + Н2О+
г) НРО4-2 + Н2О+ ↔ Н2РО4- + ОН-.
1.8.33. Напишіть механізм дії аміачної буферної системи при надходженні кислих і лужних продуктів.
1.8.34. Напишіть механізм дії на гідрокарбонтні буферні розчини кислот і лугу.
1.8.35. Напишіть механізм дії на фосфатний буферний розчин кислоти і лугу
1.8.36. Напишіть механізм дії на ацетатний буферний розчин кислоти і лугу.
1.8.37. Рівняння Гендерсона для підрахунку рН кислотних буферних систем:
а) 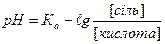
б) 
в) 
г) 

1.8.38. Рівняння Гендерсона для підрахунку рН основних буферних систем:
а) 
б) 
в) 
г) 
1.8.39. Для розрахунку рН основного буферу необхідно скористатись формулою:
а) 
б) 
в) 
г) 
1.8.40. Біохімічні буферні системи організму:
а) гідрокарбонатна, фосфатна, гемоглобінова, білкова;
б) фосфатна, ацетатна, білкова, гідрокарбонатна;
в) гемоглобінові, білкова, фосфатна, амонійна;
г) білкова, ацетатна, амонійна, фосфатна.
Рівняння обчислення рН гідрогенкарбонатного буферу
А)  ;
;
Б) 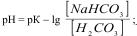
В) 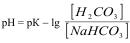
1.8.42. Формула обчислення рН для фосфатного буферу:
а)  ;
;
Б) 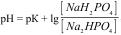 ;
;
В) 
Г) –рК.
БУФЕРНА ЄМНІСТЬ.
1.9.1. Буферна ємність це розрахункова величина:
а) визначається молярною масою еквівалента сильної кислоти, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
б) визначається кількістю еквівалентів сильної кислоти або сильної основи, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
в) визначається молярною масою еквівалента сильної основи, що треба додати до 1 л буферного розчину, щоб рН змінився на одиницю;
г) визначається кількістю еквівалентів сильної кислоти або сильної основи, що треба додати до 1 л буферного розчину, щоб рН залишився сталим.
1.9.2. На буферну ємність розчинів впливають:
а) константа дисоціації і температура;
б) співвідношення концентрації компонентів і тиск;
в) концентрація буферного розчину і співвідношення концентрації компонентів даного розчину;
г) константа дисоціації і природа буферного розчину.
1.9.3.На буферну ємкість розчинів впливають:
а) константа дисоціації і природа буферного розчину;
б) концентрація буферного розчину і співвідношення концентрації компонентів даного розчину.
в) співвідношення концентрації компонентів і тиск;
г) константа дисоціації і температури.
1.9.4. На скільки одиниць змінюється рН буферного розчину при розрахунку його буферної ємності:
а) 1; б) 2; в) 3; г) 0,5.
1.9.5. Буферну ємність розраховують за об’ємом буферного розчину:
а) 1 дм3; б) 1 см3; в) 1 м3; г) 1 мл.
1.9.6. Найбільшу буферну ємність має буферний розчин, якщо співвідношеним між кислотою і основою є:
а) більше кислоти; б) менше кислоти;
в) більше основи; г) менше основи;
д) однакові.
1.9.7. Найбільшу буферну ємність за кислотою має буферний розчин, в якому співвідношення кислоти і солі є:
а) більше кислоти; б) більше солі;
в) однаково; г) менше кислоти.
1.9.8. Розрахунок буферної ємності можна провести за:
а) кислотою і водою; б) кислотою і сіллю;
в) кислотою і основою; г) основою і сіллю.
1.9.9. Величину буферної ємності за кислотою розраховують:
а)  ; б)
; б) 
 ;
;
в)  ; г)
; г) 
 .
.
1.9.10. Величину буферної ємності за основою розраховують:
а)  ; б)
; б)  ;
;
в)  ; г)
; г)  .
.
1.9.11. Найбільшу буферну ємність має буферний розчин, якщо співвідношеним між кислотою і основою є:
а) більше кислоти; б) менше кислоти; в) однакові; г) менше основи; д) більше основи.
1.9.12. У плазмі крові найбільшу роль відіграють буферні системи:
а) аміачна; б) гідрокарбонатна;
в) ацетатна; г) гемоглобінна.
1.9.13. У плазмі крові найбільшу роль відіграють буферні системи:
а) фосфатна; б) гемоглобінова;
в) аміачна; г) ацетатна.
1.9.14. У еритроцитах переважає буферна система:
а) фосфатна; б) гемоглобінова;
в) аміачна; г) ацетатна.
1.9.15. Які функціональні групи білкових молекул зумовлюють їх буферну дію?
а) –СООН; -NO2; б) –СООН; -NН2;
в) -NН2; -CN; г) -NН2; -NO2.
1.9.16.Механізм дії буферних систем направлений на:
а) нейтралізацію кислих і лужних продуктів;
б) відновлення кислих і лужних продуктів;
в) гідроліз кислих і лужних продуктів;
г) окиснення кислих і лужних речовин.
1.9.17. Які основні протолітичні процеси відбуваються при дії на буферну систему сильної кислоти:
а) гідроліз, протоліз, нейтралізація;
б) окислення, гідроліз, протоліз;
в) електролітична дисоціація, протоліз, нейтралізація;
г) електролітична дисоціація, протоліз, гідроліз.
1.9.18. Механізм дії гідрокарбонатної буферної системипри надходженні лужних продуктів представлений рівнянням:
а) Н3О+ + НСО3- ↔ Н2СО3 + Н2О
б) Н3О+ + ОН- ↔ 2 Н2О
в) Н2СО3 + ОН- ↔ НСО3- + Н2О
г) Н2СО3 + Н2О ↔ НСО3- + Н3О+
1.9.19. Механізм дії на гідрокарбонатну буферну систему кислотою представлений рівнянням:
а) Н3О+ + ОН- ↔ 2Н2О
б) Н2СО3 + ОН- ↔ НСО3- + Н2О
в) Н3О+ + НСО3-↔ 2 Н2О
г) Н2СО3 + Н2О ↔ НСО3- + Н3О+
1.9.20. Кислотно-основна рівновага крові визначається:
а) величиною рН, концентрацією йонів НСО3-, тиском СО2 в крові;
б) величиною рН, концентрацією йонів ОН-, тиском СО2 в крові;
в) величиною рН, температурою, концентрацією йонів ОН-;
г) концентрацією йонів Н3О; ОН-, температурою.
1.9.21. Лужний резерв крові вимірюється:
а) об’ємом СО2; б) об’ємом СО;
в) Об’ємом НО2; г) Об’ємом NО2.
1.9.22. При якому співвідношенні НСО3-:Н2СО3 рН гідрокарбонатного буферу відповідає рН крові:
а) 20:1; б) 15:1; в) 1:1; г) 1:20.
1.9.23. Механізм дії буферної системи оксигемоглобін-гемоглобін при надходженні кислих продуктів представлений рівнянням:
а) ННb + OH- ↔ Hb- + H2O
HHbO2 + OH- ↔ HbO2- + H2O;
б) Hb- + H3O+ ↔ ННb + H2O
HbO2- + H3O+ ↔ HHbO2 + H2O;
в) Hb- + H2O ↔ ННb + OH-
HbO2- + H2O ↔ HHbO2 + OH-;
г) Hb- + Н2СО3 ↔ HHbO2 + НСО3-
HbO2- + Н2СО3 ↔ HHbO2 + НСО3-.
1.9.24. Буферна система оксигемоглобін-гемоглобін характеризується рівновагою між йонами:
а) Hb- і ННb б) Hb- і OH-
HbO2- і HHbO2; HbO2- і OH-;
в) Hb- і H3O+ г) Hb- і HHbO2
HbO2- і H3O+; HbO2- і ННb.
1.9.29. Значення рН плазми крові в нормі може знаходитись:
а) 7,35-7,45; б) 6,80-7,0;
в) 7,15-7,35; г) 8,01-8,35.
1.9.30. Зрушення кислотно-основного стану крові у сторону підвищення концентрації йонів водню (зниження рН) називають:
а) алкалозом; б) анабіозом;
в) ацидозом; г) антагонізмом.
1.9.31. Зрушення кислотно-основного стану крові у сторону зменшення концентрації йонів водню (підвищення рН) називають:
а) ацидозом; б) алкалозом;
в) анабіозом; г) антагонізмом.
1.9.32. Яку із наведених речовин можна використовувати для коригування кислотно-основного стану організму при ацидозі:
а) NaHCO3; б) NaCl
в) HCl г) аскорбінову кислоту.
1.9.33. Механізм дії білкової буферної системи при надходженні кислих продуктів представлений рівняням:
а)  ;
;
б) 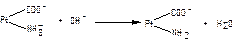 ;
;
в)  ;
;
г)  ;
;
1.9.34. Механізм дії на фосфатну буферну систему кислотою представлений рівнянням:
а) НРО4-2 + Н2О ↔ Н2РО4- + ОН-;
б) Н2РО4- + ОН- ↔ НРО4-2 + Н2О;
в) НРО4-2 + Н3О ↔ Н3РО4 + ОН-;
г) НРО4-2 + Н3О ↔ Н2РО4- + Н2О.
1.9.35. Напишіть механізм дії буферної системи оксигемоглобін-гемоглобін при надходженні кислих продуктів.
1.9.36. Напишіть механізм дії на білкову буферну систему сильної кислоти і лугу.
HHbO2 + OH- ↔ HbO2- + H2O