 |
|
Пример: основной Ме – Со; примеси – Zn и Cu.
Покажите ход поляризационных кривых
По закону Фарадея
 г
г 
 г
г
Рассчитаем объем (при н.у. 1 моль газа V0m = 22,4 л)
 л
л 
 л
л
В лабораторной работе №18 измеренный объем следует привести к н.у.
По уравнению Менделеева-Клапейрона

▲ Задача
Рассмотрите электролиз водного раствора CuCl2 на Cu-электродах. Напишите уравнения электродных процессов. Покажите ход поляризационных кривых.
Решение. Ионный состав раствора:
CuCl2 → Cu2+ + 2Cl-
H2O → H+ + OH-
рН=5 Þгидролиз соли слабого основания и сильной кислоты
Потенциалы возможных процессов:
[- K]: Е0Сu2+/Cu = + 0,337В ЕрН+/Н2 = -0,059рН = -0,295В
Е0Сu2+/Cu > ЕрН+/Н2 Þтолько один процесс
[+A]: ЕрО2/ОН- =1,23-0,059рН = +0,935В;Е0Сl2/Cl- = + 1,36В
Е0Сu2+/Cu < ЕрО2/ОН- < Е0Сl2/Cl-
Электродные процессы:
[- K]: Cu2+ + 2е → Cu0
[+A]: Cu0 → Cu2+ + 2е (растворение электрода)
4ОН- → О2 ↑ + 2Н2О + 4е
2Cl- → Cl2 + 2e

 |  |

 | ||||||
 | ||||||
 | ||||||
 | ||||||
Назначение гальванических покрытий:
· Защита от коррозии
· Защитно-декоративное
· Повышение электропроводности
· Повышение твердости и износостойкости
· Получение магнитных пленок
· Уменьшение коэффициента трения
· Улучшение способности к пайке
· Улучшение отражательной способности поверхности
▲ Задача
Рассчитайте толщину никелевого покрытия на стальном изделии поверхностью 1 м2 и изменение толщины Ni анода поверхностью 1 м2 при э/х никелировании в течение 1 ч из водного раствора на основе Ni2SO4, если катодная плотность тока – 100 А/м2, а анодная – 50 А/м2. Выход по току Ni на катоде – 0,8, а на аноде – 0,9. Плотность Ni ρ=8,9 г/см2. (Гидролизом пренебречь, рН=7).
Решение.
Сравнивая значения электродных потенциалов, записываем последовательность возможных электродных процессов:
[- K]: Ni2+ + 2e → Ni
2Н+ + 2е → Н2↑
[+A, Ni]: Ni → Ni2+ + 2e
4ОН- → О2 ↑ + 2Н2О + 4е
По закону Фарадея

Толщина Ni покрытия на изделии равна:

Масса растворившегося никелевого анода:

Изменение толщины Ni анода:
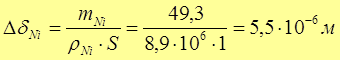 =5,5 мкм
=5,5 мкм
 | |||||
 | |||||
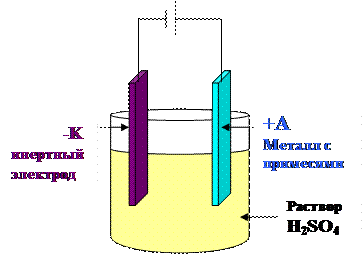 | |||||
Пример: основной Ме – Со; примеси – Zn и Cu.
Как провести очистку в растворе H2SO4?
Ионный состав раствора:
H2SO4 → H+ + SO42-
H2O ↔ H+ + OH- рН=1

 На аноде: SO42-, OH-, Со, Zn, Cu
На аноде: SO42-, OH-, Со, Zn, Cu
Выписываем все потенциалы
Е0Н+/Н2= 0 В (т.к. рН=1)
ЕрО2/ОН- =1,23-0,059рН = +1,17В;
Е0Co2+/Co = - 0,277В
Е0Zn2+/Zn =-0,76В;
Е0Сu2+/Cu =+ 0,337В
Þ [+A]: Zn0 → Zn2+ + 2е (в первую очередь, т.к. Е0Zn2+/Zn< Е0Co2+/Co)
Co0 → Co2+ + 2е
Cu не растворяется и выпадает в шлам, а затем ее собирают со дна.
На катоде: H+; Co2+; Zn2+
[- K]: 2Н+ + 2е → Н2↑ сначала, пока сСо=0
Cо2+ + 2е → Cо0 затем
а ионыZn2+ остались в растворе