 |
|
Теоретическое введение
РАВНОВЕСИЕ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Цель работы: изучить теоретические основы равновесия в водных растворах электролитов и экспериментально определить константу диссоциации слабого электролита.
Теоретическое введение
Современная теория растворов основана на представлениях С. Аррениуса о частичной диссоциации электролитов. Характеристикой раствора электролита является его степень диссоциации α, представляющая собой отношение числа распавшихся на ионы частиц Nдис к их общему числу до диссоциации Nобщ:
α =  (1)
(1)
Процесс диссоциации электролитов является обратимым, так как находящиеся в растворе противоположно заряженные ионы могут вновь соединяться в молекулы. Для частиц, диссоциирующих на два иона:
КА  К+ + А-
К+ + А-
где К+ и А- - катион и анион. Состояние равновесия характеризуется константой электролитической диссоциации Кдис, связанной с молярными концентрациями с (К+) катионов, анионов с (А-) и молекул электролита с (КА) соотношением:
 (2)
(2)
Константа электролитической диссоциации связана со степенью диссоциации и молярной концентрацией электролита с с(Х) выражением, известным под названием закона разведения Оствальда:
 (3)
(3)
Для слабых электролитов увеличение эквивалентной электропроводимости с разбавлением связано с увеличением степени диссоциации электролита, что приводит к повышению числа ионов. При бесконечном разбавлении α ≈ 1, т.е. все молекулы диссоциированы полностью и λV = λ∞. В общем случае:
λV = αλ∞ или α =  (4)
(4)
Уравнение (5) позволяет рассчитать константу диссоциации Кдис слабого электролита.
Подставив в уравнение (4) значение α =  , получим:
, получим:
Кдис =  (5)
(5)
В сильных электролитах молекулы полностью диссоциированы на ионы, между которыми возникают силы электролитического взаимодействия. В результате такого взаимодействия вокруг каждого иона группируется избыток ионов противоположного знака, которые образуют вокруг него ионную атмосферу (ионное облако). Этот ион является центральным и одновременно может входить в состав одной или нескольких ионных атмосфер других ионов, что обусловливает сложное взаимодействие между ионами.
Для учета взаимного притяжения ионов, взаимодействия растворенного вещества с растворителем и других явлений для сильных электролитов введено понятие активности раствора, соответствующее их активной концентрации и действующей при химических реакциях.
С разбавлением раствора силы межионного взаимодействия уменьшаются и значения активности приближаются к значению молярной концентрации. Активность связана с молярной концентрацией раствора соотношением
 (6)
(6)
где f- коэффициент активности
При увеличении разбавления раствора коэффициент активности f приближается к единице, а его активность становится равной молярной концентрации – a=c(x)
Величина коэффициента активности зависит от общего ионного состава раствора и концентрации ионов.
В разбавленных растворах сильных электролитов эквивалентная электропроводимость линейно зависит от корня квадратного из концентрации электролита.
 (7)
(7)
Постоянная А зависит от природы электролита, растворителя и температуры и экспериментально определяется тангенсом угла наклона
прямой к оси абсцисс.
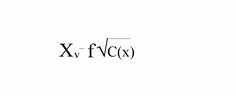 (8)
(8)

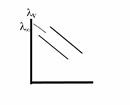
рис. (1) рис. (2)