 |
|
Расчетные и фактические результаты опыта
ЛАБОРАТОРНАЯ РАБОТА № 5
Тема: Приготовление растворов
&Тезаурус темы
Дисперсные системы – это гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
Растворы –это многокомпонентные гомогенные системы переменного состава (размер частиц менее 10-7 см).
Кристаллогидраты –это вещества, содержащие в своей структуре воду.
Массовая доля –это масса растворенного вещества, деленная на массу раствора.

Мольная доля –это количество моль растворенного вещества, деленное на количество моль раствора.
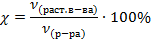
Объемная доля –это объем растворенного вещества, деленный на объем раствора.

Молярность –это количество моль вещества в 1 литре раствора.

Моляльность– это количество моль вещества в 1 кг (1000 г) растворителя.

Нормальность – это количество моль эквивалентов вещества в 1 литре раствора.
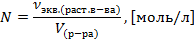
Титр –это масса вещества в объеме раствора.

MЭкспериментальная часть
ОПЫТ № 1. Приготовление раствора заданной процентной концентрации
Реактивы
Хлорид натрия (кристаллический), сульфат натрия (кристаллический), нитрат натрия (кристаллический), сульфат аммония (кристаллический), хлорид аммония (кристаллический), хлорид калия (кристаллический).
Оборудование
Весы электронные, химический стакан, мерный цилиндр, ареометр.
Ход работы
?Произвести расчет массы вещества и воды для приготовления раствора одной из указанных солей заданной процентной концентрации, которую укажет преподаватель:
1. Взвесить рассчитанную навеску вещества, раствор которого требуется приготовить, перенести ее в стакан. Мерным цилиндром отмерить расчетное количество воды и перелить ее в стакан с навеской вещества. Раствор перемешать до полного растворения соли.
2. Точность концентрации приготовленного раствора проверить по плотности, измерив ее с помощью ареометра. Для этого перелить приготовленный раствор в цилиндр и погрузить в него ареометр.
3. По измеренной фактической плотности в справочнике (спросить у преподавателя) найти фактическую процентную концентрацию раствора.
? Заполните табл. 1.
Таблица 1
Расчетные и фактические результаты опыта
| Задание | Расчетные данные | Плотность раствора, г/мл | Фактическая концентрация раствора, % | ||
| масса соли, г | объем воды, мл | Теоретическая | Фактическая | ||
| Приготовить __ мл __ %-ного раствора _______. |
? Рассчитать абсолютную (∆ω) и относительную (ε) погрешности опытам по формулам (1)-(2):
∆ω = ωзадан – ωфакт (1)

∆ω =
ε =
ОПЫТ № 2. Приготовление раствора заданной молярной (нормальной) концентрации
Реактивы
Хлорид натрия (кристаллический), сульфат натрия (кристаллический), нитрат натрия (кристаллический), сульфат аммония (кристаллический), хлорид аммония (кристаллический), хлорид калия (кристаллический).
Оборудование
Весы электронные, мерная колба, ареометр, мерный цилиндр.
Ход работы
?Произвести расчет массы вещества для приготовления раствора одной из указанных солей заданной молярной (нормальной) концентрации, которую укажет преподаватель:
1. Взвесить рассчитанную навеску вещества, раствор которого требуется приготовить, перенести ее в мерную колбу. Постепенно вливая в мерную колбу небольшое количество воды и перемешивая, довести общий объем раствора до метки на колбе.
2. Точность концентрации приготовленного раствора проверить по плотности, измерив ее с помощью ареометра. Для этого перелить приготовленный раствор в цилиндр и погрузить в него ареометр.
3. По измеренной фактической плотности в справочнике (спросить у преподавателя) найти фактическую молярную (нормальную) концентрацию раствора.
? Заполните табл. 1.
Таблица 1