 |
|
Концентрация. Способы выражения концентрации
Концентрация –показывает, сколько вещества растворено в данном растворе или растворители.
Концентрации вещества можно выразить:
I. Массовая доля (w%), процентная концентрация (С%) – показывает сколько единиц массы вещества растворено в 100 единицах массы раствора (количество грамм растворенного вещества в 100 граммах раствора).
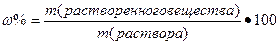



 ,
,
где V – объем раствора, P- плотность раствора.
Нахождение массы растворенного вещества:
 или
или

Примеры:
- 5% раствор поваренной соли.
Это значит, что в 100 грамм этого раствора содержится 5 грамм поваренной соли и 95 грамм воды.
- Какова массовая доля соли в растворе, если в 200 г воды растворили 50 г соли?
| Дано | Решение |
| m соли = 50 грамм m воды = 200 грамм Найти: w% ? | 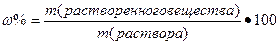

 Ответ: 20 % раствор
Ответ: 20 % раствор
|
Реши самостоятельно:
- Какие массы поваренной соли и воды надо взять для приготовления 500 г раствора с массовой долей соли в нем 4%.
- В 100 г воды растворили 31,6 г нитрата калия. Рассчитайте массовую долю растворенного вещества в растворе этой соли.
- Рассчитайте массу сахара и массу воды которые нужно взять для приготовления 600 г сиропа с массовой долей сахара в нем 10%.
- В 800 г раствора сульфата меди содержится 40 г сульфата меди. Вычислите массовую долю сульфата меди в растворе.
- Какую массу нитрата серебра надо растворить в 250 г воды для приготовления 2% - ного раствора.
II. Молярная концентрация раствора (См) – количество вещества растворенного в 1000 мл раствора (1 л) (выражается числом молей в одном литре раствора).
1М одномолярный раствор = 1 моль/л
2 М двумолярный раствор =2 моль/л
0,1 М децимолярный раствор
0,2 М двудецимолярный раствор
0,01 М сантимолярный раствор
0,001 М милимолярный раствор
 (м),
(м),
где М – молярная масса растворенного вещества, V – объем полученного раствора
или  (моль/л)
(моль/л) 
Нахождение массы растворенного вещества:
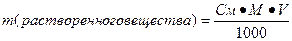
Примеры:
- Приготовить децимолярный раствор сульфата натрия.
См=0,1 м
М (Na2SО4)=142 г/моль
m(Na2SО4)=142  0,1=14,2 г
0,1=14,2 г
Отвешиваем 14,2 г сульфата натрия, высыпаем в мерную колбу и доливаем воды до 1 литра.
2. Приготовить 600 мл 2 м раствора карбоната натрия.
| Дано | Решение |
| V = 600 мл См =2м Найти m соли (Na2СО3) ? |  М Na2СО3= 106 г/моль
m=
М Na2СО3= 106 г/моль
m=  Отвесить 127,2 г соли, высыпать в мерную колбу и долить воды до метки 600.
Отвесить 127,2 г соли, высыпать в мерную колбу и долить воды до метки 600.
|
Реши самостоятельно:
1. Сколько грамм тиосульфата натрия Na2S2O3  5Н2О нужно для приготовления 250 мл 0,1 м раствора.
5Н2О нужно для приготовления 250 мл 0,1 м раствора.
2. 66,8 г серной кислоты растворили в 133 г воды. Определите молярную концентрацию если раствор с плотностью 1,25 гр/см3.
3. Вычислите молярность раствора, приготовленного в мерной колбе на 500 мл из 4,98 г КI.
4. Рассчитайте массу вещества Na2СО3, содержащегося в 200 мл 0,24 М раствора.
5. Определите молярную концентрацию вещества в растворе CuSO4, приготовленном в мерной колбе на 500 мл из 11,25 г кристаллогидрата CuSO4  5Н2О.
5Н2О.
Какая масса сульфата бария ВаSO4 получится при сливании 200 мл 0,5 м раствора сульфата алюминия Al2(SO4)3 и 150 мл 2 м раствора хлорида бария ВаСl2
III. Нормальная концентрация или эквивалентная (Сн, Сэ, СN) –выражается числом эквивалентов растворенного вещества в 1 л раствора.

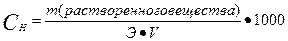 (н),
(н),
где Э – эквивалент растворенного вещества, V – объем
или  (экв/л)
(экв/л)
Нахождение массы растворенного вещества:

Эквивалент – реальная или условная частица вещества, которая химически равноценна одному иону водорода (для обменных реакций) или одному электрону (для окислительно – восстановительных реакций). Фактически это частица, обладающая одной единицей валентности или оперирующая одним электроном.
Эквиваленты сложных веществ находятся:
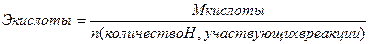 ;
;
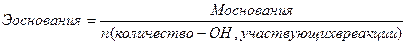 ;
;
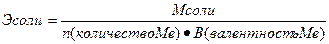 ;
;
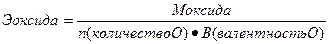 .
.
Примеры:
- Приготовить 400 мл сантинормального раствора сульфата натрия.
Сн=0,01 н 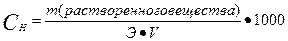
V=400 мл
М(Na2SO4)=142 г/моль преобразуем формулу
Э(Na2SO4)=71 
m(Na2SO4)=0,01  71
71  400
400  1000=0,284 г
1000=0,284 г
2. Определить нормальную концентрацию раствора содержащего 30 г хлорида алюминия в 500 мл раствора.
| Дано | Решение |
| m (AlCl3)=30 г V=500 мл Найти Сн-? | 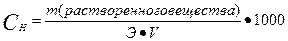 Э (AlCl3)=
Э (AlCl3)=  Э (AlCl3)=133,5:3=44,5
Сн=
Э (AlCl3)=133,5:3=44,5
Сн= 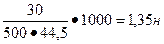
|
Реши самостоятельно:
- Сколько грамм азотной кислоты содержится в 2 л ее 0,1 н раствора?
- Сколько гр ортофосфорной кислоты нужно для приготовления 10 мл 0,02 н раствора?
- Какой объём 0,5 н раствора можно приготовить из 24,44 г кристаллогидрата хлорида бария ВаСl2
 2 H2O?
2 H2O? - Для нейтрализации 25 мл раствора серной кислоты потребовалось 40 мл 0,1 н раствора гидроксида натрия. Определите Сн раствора кислоты.
- Какую реакцию имеет раствор, полученный при смешивании 100 мл 0,1 н раствора серной кислоты с 50 мл 0,5 н раствора гидроксида калия? Сколько грамм образуется сульфата калия?
IV. Моляльная концентрация (Сm)– выражается числом молей растворенного вещества в 1000 гр растворителя
 =
= 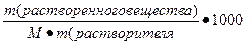
V. Титр (T)- сколько грамм растворенного вещества содержится в 1 мл раствора.
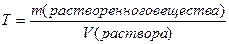
Переходы концентраций.
Переход от процентной концентрации к молярной концентрации:
 или
или 
Переход от процентной концентрации к нормальной концентрации:
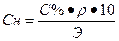 или
или 
Переход от молярной концентрации к процентной концентрации:
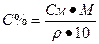
Переход от нормальной концентрации к процентной концентрации:
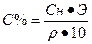
Примеры:
1. Определить нормальную концентрацию 20 % - ного раствора серной кислоты , если ρ=1,14 г/см3.
| Дано | Решение |
| С%=20 % ρ (H2SO4) = 1,14 г/см3 Найти Сн-? | 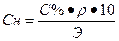 , , 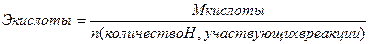 Э (H2SO4) =
Э (H2SO4) =  Сн =
Сн =  Ответ: Сн=4,65 н
Ответ: Сн=4,65 н
|
Реши самостоятельно:
1. Найти молярную концентрацию 60 % - ного раствора азотной кислоты, если плотность раствора равна 1,373 г/см3.
2. Определить С% двунормального раствора серной кислоты с плотностью 1,063 г/см3.
3. 66,8 г серной кислоты плотностью = 1,25 г/см3 растворили в 133,2 г воды. Определите С%, См, Сн .
4. Какой объём 68% - ного раствора азотной кислоты плотностью 1,4 г/см3 требуется для приготовления 50 мл 2 н раствора?
5. Найдите молярную концентрацию вещества Na2SO4 в 12% - ном растворе с плотностью 1,11 г/мл.