 |
|
ТРУДНОРАСТВОРМЫХ ЭЛЕКТРОЛИТОВ
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Закон действия масс применим к гетерогенной равновесной системе, состоящей из кристаллов малорастворимого электролита (соли, основания, кислоты) и его ионов в насыщенном растворе. Рассмотрим равновесия, наблюдаемые в насыщенном растворе какого-нибудь труднорастворимого вещества, например, CaSO4. В этой системе осадок находится в равновесии с насыщенным раствором этого вещества:
СaSO4  Ca2+ + SO42–
Ca2+ + SO42–
осадок раствор
При установившемся гетерогенном ионном равновесии в раствор переходит в единицу времени столько ионов, сколько их снова возвращается в осадок (вследствие ничтожно малой растворимости считаем, что степень ионизации электролита в растворе равна 1). Константа равновесия для процесса растворения осадка имеет следующий вид:
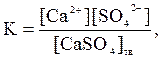
откуда, K∙[CaSO4]тв = [Ca2+]∙[SO42-]
Концентрация твердого вещества есть величина постоянная:
[CaSO4]тв = const.
Учитывая это, K∙[CaSO4]тв как произведение двух постоянных величин также можно считать величиной постоянной, некоторой константой, характерной для данного вещества. Эту константу называют произведением растворимости. Её обозначают через ПР:

Для насыщенного раствора сульфата кальция произведение растворимости при 25оС найдено равным 3,72∙10-5 г-ион2/л2.
Произведение растворимости характеризует растворимость электролитов. Для бинарных электролитов растворимость численно равна
 s = √ПР.
s = √ПР.
В общем случае, если малорастворимый электролит имеет сложный состав AnBm и при его диссоциации образуется более двух ионов:
AnBm ↔ nAa+ + mBb–,
то в выражении константы равновесия записывают концентрации ионов в степенях, равных стехиометрическим коэффициентам n и m.
Тогда
ПР = [Aa+]n [Вb–]m
Следовательно, для насыщенного водного раствора малорастворимого электролита произведение равновесных молярных концентраций его ионов в степенях, равных стехиометрическим коэффициентам, при данной температуре есть величина постоянная, называемая произведением растворимости.
Сравнивая значения произведений растворимости труднорастворимых солей, можно видеть, какая из них растворяется лучше (табл. 15).
Значения ПР используются в общей химии, аналитической химии, гидрохимии, химии океана, экологии и др., т. к. позволяют количественно оценить:
─ условия образования и растворения осадков;
─ рассчитать растворимость труднорастворимого электролита;
─ рассчитать молярную концентрацию ионов электролита в насыщенном растворе.
Из величины ПР вытекает условие образования и растворения осадка:
1. Если [Aa+]n [Вb–]m = ПР, то осадок находится в равновесии с раствором (насыщенный раствор);
2. Если [Aa+]n [Вb–]m > ПР, то осадок выпадает (перенасыщенный раствор);
3. Если [Aa+]n [Вb–]m < ПР, то осадок растворяется (ненасыщенный раствор).
Таблица 15.
Произведение растворимости некоторых
малорастворимых электролитов при 25 оС
| Электролит | ПР | Электролит | ПР | Электролит | ПР |
| AgBr | 5,3·10-13 | CaSO4 | 2,5·10-5 | MnS | 2,5·10-10 |
| Ag2CO3 | 8,2·10-12 | Ca3(PO4)2 | 1,0·10-29 | Ni(OH)2 | 6,3·10-18 |
| AgCl | 1,8·10-10 | CdS | 1,6·10-28 | PbBr2 | 9,1·10-6 |
| Ag2CrO4 | 1,1·10-12 | CoCO3 | 1,5·10-10 | PbCO3 | 7,5·10-14 |
| AgI | 8,3·10-17 | Co(OH)2 | 2·10-16 | PbCl2 | 1,56·10-5 |
| Ag2S | 5,3·10-50 | CrPO4 | 2,4·10-23 | PbF2 | 2,7·10-8 |
| Ag2SO4 | 1,6·10-5 | CuCO3 | 2,5·10-10 | PbI2 | 1,1·10-9 |
| Ag3PO4 | 1,3·10-20 | Cu(OH)2 | 1,6·10-19 | PbS | 2,5·10-27 |
| Al(OH)3 | 5·10-33 | CuS | 6,3·10-36 | PbSO4 | 1,6·10-8 |
| AlPO4 | 5,7·10-19 | Fe(OH)2 | 8·10-16 | Pb3(PO4)2 | 7,9·10-43 |
| BaCO3 | 5,1·10-9 | Fe(OH)3 | 6,3·10-38 | Sb2S3 | 1,6·10-93 |
| BaCrO4 | 1,2·10-10 | FePO4 | 1,3·10-22 | SrCO3 | 1,1·10-10 |
| BaSO4 | 11·10-10 | FeS | 5·10-18 | SrCrO4 | 3,6·10-5 |
| Ba3(PO4)2 | 6,0·10-39 | HgS | 1,6·10-52 | SrF2 | 2,5·10-9 |
| BeCO3 | 1·10-3 | MgCO3 | 2,1·10-5 | SrSO4 | 3,2·10-7 |
| CaCO3 | 4,8·10-9 | Mg(OH)2 | 6·10-10 | ZnCO3 | 1,4·10-14 |
| CaF2 | 4,0·10-11 | Mg3(PO4)2 | 1·10-13 | Zn(OH)2 | 1·10-17 |
| CaHPO4 | 2,7·10-7 | MnCO3 | 1,8·10-11 | α-ZnS | 1,6·10-24 |
| Ca(H2PO4)2 | 1·10-3 | Mn(OH)2 | 1,9·10-13 | Zn3(PO4)2 | 9,1·10-33 |
Таким образом, если при той или иной химической реакции, произведение концентраций участвующих в ней ионов станет больше произведения растворимости, то выпадает осадок труднорастворимого вещества. И обратно, если произведение концентраций ионов данного электролита в насыщенном его растворе в результате той или иной реакции становится меньше произведения растворимости для ионов этого электролита, то осадок переходит в раствор.
Из всего сказанного выше можно сделать вывод о влиянии различных факторов на образование осадков.
Влияние концентрации растворов. Труднорастворимый электролит с достаточно большой величиной ПР нельзя осадить из разбавленных растворов. Например, осадок PbCl2 не будет выпадать при смешении равных объемов 0,1 M растворов Pb(NO3)2 и NaCl. При смешивании равных объемов концентрации каждого из веществ станут 0,1 / 2 = 0,05 M или 5·10-2 моль/л. Ионное произведение [Pb2+]·[Cl‾]2 = 5·10-2·(5·10-2)2 = 12,5·10-5. Полученная величина меньше ПР(PbCl2), следовательно выпадения осадка не произойдет.
Влияние количества осадителя.Для возможно более полного осаждения употребляют избыток осадителя. Например, осаждаем соль BaCO3:
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl.
После прибавления эквивалентного количества Na2CO3 в растворе остаются ионы Ba2+, концентрация которых обусловлена величиной ПР. Повышение концентрации ионов CO32-, вызванное прибавлением избытка осадителя (Na2CO3), повлечет за собой соответственное уменьшение концентрации ионов Ba2+ в растворе, т.е. увеличит полноту осаждения этого иона.
Влияние одноименного иона.Растворимость труднорастворимых электролитов понижается в присутствии других сильных электролитов, имеющих одноименные ионы. Если к ненасыщенному раствору BaSO4 понемногу прибавлять раствор Na2SO4, то ионное произведение, которое было сначала меньше ПР(BaSO4) (1,1·10-10), постепенно достигнет ПР и превысит его. Начнется выпадение осадка.
Это используют, например, при осаждении ценных металлов. Например, ПР AgCl в воде =1,6×10-10. Концентрация серебра в таком растворе над AgCl будет
 моль/л.
моль/л.
Много это или мало? Это 1,4 мг серебра, выливаемого с каждым литром промывных жидкостей на кинофабрике. Если же мы будем промывать не водой, а 0,1н раствором NaCl, то
[Ag+] = ПР/[Cl] = 1.6×10-9моль/л,
т.е. концентрация серебра, уносимая в растворе, уменьшится в 10 000 раз.
Влияние температуры.ПР является постоянной величиной при постоянной температуре. С увеличением температуры ПР возрастает, поэтому осаждение лучше проводить из охлажденных растворов.
Растворение осадков.Правило произведения растворимости важно для переведения труднорастворимых осадков в раствор. Предположим, что надо растворить осадок BaСO3. Раствор, соприкасающийся с этим осадком, насыщен относительно BaСO3.Это означает, что
[Ba2+]·[CO32-] = ПР(BaCO3).
Если добавить в раствор кислоту, то ионы H+ свяжут имеющиеся в растворе ионы CO32- в молекулы непрочной угольной кислоты:
 CO2↑
CO2↑
 2H+ + CO32- → H2CO3
2H+ + CO32- → H2CO3
H2O
Вследствие этого резко снизится концентрация иона CO32- , ионное произведение станет меньше величины ПР(BaCO3). Раствор окажется ненасыщенным относительно BaСO3 и часть осадка BaСO3 перейдет в раствор. При добавлении достаточного количества кислоты можно весь осадок перевести в раствор. Следовательно, растворение осадка начинается тогда, когда по какой-либо причине ионное произведение малорастворимого электролита становится меньше величины ПР. Для того, чтобы растворить осадок, в раствор вводят такой электролит, ионы которого могут образовывать малодиссоциированное соединение с одним из ионов труднорастворимого электролита. Этим объясняется растворение труднорастворимых гидроксидов в кислотах
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Ионы OH‾ связываются в малодиссоциированные молекулы H2O.
Зная ПР, можно объяснить, почему одни вещества растворяются, а другие – нет. И наоборот, легко объяснить, почему одни вещества выпадают в осадок, а другие – нет.
Например, FeS растворяется в соляной кислоте, а СuS – нет:
FeS + 2HCl → FeCl2 + H2S
CuS + HCl ≠
Величины значений ПР(FeS) = 3,7·10–19, ПР(CuS) = 8,5·10–45.Отсюда следует, что в случае сульфида меди в насыщенном растворе находится очень мало ионов S2–, и молекулы H2S не будут образовываться, а, следовательно, равновесие в насыщенном растворе сульфида меди не будет нарушаться. Осадок не будет растворяться. В случае же сульфида железа (II) сульфид-ионов достаточно для образования молекул H2S, и равновесие сдвигается вправо. Осадок сульфида железа (II) растворяется.
Другой пример: FeS не осаждается из раствора с помощью H2S и осаждается раствором (NH4)2S:
FeCl2 + H2S ≠
FeCl2 + (NH4)2S = FeS↓ + 2NH4Cl
Сероводородная кислота является слабой (К2 = 1·10–14). Отсюда ионов S2-недостаточно для выполнения условия
[Fe2+][S2–] > ПР,
и осадок не выпадает.
Сульфид аммония – сильный электролит, и сульфид-ионов достаточно для выполнения вышеуказанного условия. А это приводит к выпадению осадка.
Произведение растворимости можно использовать для селективного разделения ионов осаждением из растворов.
Например, рассмотрим осаждениеионов Ba2+ и Sr2+ из раствора, содержащего 0,010 моль/л BaCl2 и 0,020 моль/л SrCl2, используя концентрированный раствор Na2SO4.
ПР сульфатов бария и стронция определяется соотношениями
ПР = [Ba2+][SO42–] = 1,5·10–9;
ПР = [Sr2+][SO42–] = 7,6·10–7.
Следовательно, осаждение сульфата бария при наличии 0,010 моль/л ионов Ва2+ не будет происходить до тех пор, пока концентрация иона SO42-не достигнет величины
[SO42–] = 1,5·10–9 / 0,010 = 1,5·10–7 моль/л.
Осаждение сульфата стронция начнётся при концентрации сульфат-иона, равной
[SO42–] = 7,6·10–7 / 0,020 = 3,8·10–5 моль/л.
Следовательно, ионы бария начнут осаждаться первыми. При достижении концентрации сульфат-ионов величины 3,8·10–5 моль/л начнется осаждение сульфата стронция. К тому времени в растворе останется
[Ba2+] = 1,5·10–9 / 3,8·10–5 = 3,9·10–5 моль/л.
Это составит только 0,39% от исходного количества ионов бария. Остальные 99,6% ионов бария будут осаждены до начала выпадения осадка сульфата стронция.