 |
|
КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ
Вещества, изменяющие окраску при изменении реакции среды, – индикаторы – чаще всего сложные органические соединения – слабые кислоты или слабые основания. Схематично состав индикаторов можно выразить формулами НInd или IndOH, где Ind – сложный органический анион или катион индикатора.
Практически индикаторы применяли давно, но первая попытка в объяснении их действия была сделана в 1894 году Оствальдом, создавшим так называемую ионную теорию. Согласно этой теории, недиссоциированные молекулы индикатора и его Ind–ионы имеют в растворе разную окраску, и окраска раствора изменяется в зависимости от положения равновесия диссоциации индикатора. Например, фенолфталеин (кислотный индикатор) имеет молекулы бесцветные, а анионы малиновые; метилоранж (основной индикатор) – желтые молекулы и красные катионы.
фенолфталеин метилоранж
HInd  H+ + Ind– IndOH
H+ + Ind– IndOH  Ind+ + OH–
Ind+ + OH–
бесцв. малинов. желт. красн.
Изменение [H+] в соответствии с принципом Ле-Шателье приводит к смещениию равновесия вправо или влево.
Согласно хромофорной теории (Ганч), появившейся позднее, изменение окраски индикаторов связано с обратимой перегруппировкой атомов в молекуле органического соединения. Такая обратимая перегруппировка в органической химии называется таутомерией. Если в результате таутомерного изменения строения в молекуле органического соединения появляются особые группировки, называемые хромофорами, то органическое вещество приобретает окраску. Хромофорами называются группы атомов, которые содержат одну или несколько кратных связей, вызывающие избирательное поглощение электромагнитных колебаний в УФ области. В роли хромофорных групп могут выступать группировки атомов и связей, как −N=N− , =С=S , −N=О, хиноидные структуры и т.д.
Когда таутомерное превращение ведет к изменению строения хромофора – окраска изменяется; если же после перегруппировки молекула не содержит более хромофора – окраска исчезнет.
Современные представления основывываются на ионно-хромофорной теории, согласно которой изменение окраски индикаторов обусловлено переходом из ионной формы в молекулярную, и наоборот, сопровождающегося изменением структуры индикаторов. Таким образом, один и тот же индикатор может существовать в двух формах с разным строением молекул, причем эти формы могут переходить одна в другую, и в растворе между ними устанавливается равновесие.
В качестве примера можно рассмотреть структурные изменения в молекулах типичных кислотно-основных индикаторов – фенолфталеина и метилового оранжевого под действием растворов щелочей и кислот (при различных значениях рН).
Реакция, в результате которой, благодаря таутомерной перестройке структуры молекулы фенолфталеина в ней возникает хромофорная группировка, обусловливающая появление окраски, протекает согласно следующему уравнению:



бесцветный бесцветный бесцветный


малиновый
Индикаторы, как слабые электролиты, имеют малые величины констант диссоциации. Например, Кд фенолфталеина равна 2∙10-10 и в нейтральных средах он находится преимущественно в виде своих молекул вследствие очень малой концентрации ионов, почему и остается бесцветным. При добавлении щелочи Н+-ионы фенолфталеина связываются, «стягиваются» с ОН–-ионами щелочи, образуя молекулы воды, и положение равновесия диссоциации индикатора смещается вправо – в сторону увеличения концентрации Ind–-ионов. В щелочной среде образуется двунатриевая соль, имеющая хиноидное строение, что вызывает окраску индикатора. Смещение равновесия между таутомерными формами происходит постепенно. Поэтому и цвет индикатора изменяется не сразу, а переходя через смешанную окраску к цвету анионов. При добавлении в этот же раствор кислоты одновременно с нейтрализацией щелочи – при достаточной концентрации Н+-ионов – положение равновесия диссоциации индикатора смещается влево, в сторону моляризации, раствор снова обесцвечивается.
Аналогично происходит изменение окраски метилоранжа: нейтральные молекулы метилоранжа придают раствору желтый цвет, который в результате протонирования переходит в красный, соответствующий хиноидной структуре. Этот переход наблюдается в интервале рН 4.4–3.1:
 |
желтый красный
Таким образом, окраска индикаторов зависит от рН-среды. Интенсивность окраски таких индикаторов достаточно велика и хорошо заметна даже при введении небольшого количества индикатора, не способного существенно повлиять на рН раствора.
Раствор, содержащий индикатор, непрерывно изменяет свою окраску при изменении рН. Человеческий глаз, однако, не очень чувствителен к таким изменениям. Диапазон, в котором наблюдается изменение окраски индикатора, определяется физиологическими пределами восприятия цвета человеческим глазом. При нормальном зрении глаз способен различить присутствие одной окраски в смеси ее с другой окраской только при наличии как минимум некоторой пороговой плотности первой окраски: изменение окраски индикатора воспринимается только в той области, где имеется 5-10-кратный избыток одной формы по отношению к другой. Рассматривая в качестве примера HInd и характеризуя состояние равновесия
HInd  H+ + Ind–
H+ + Ind–
соответствующей константой
 ,
,
можно написать, что индикатор проявляет свою чисто кислотную окраску, обычно улавливаемую наблюдателем, при
 ,
,
а чисто щелочную окраску при
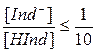 .
.
Внутри интервала, определяемого этими величинами, проявляется смешанная окраска индикатора.
Таким образом, глаз наблюдателя различает изменение окраски лишь при изменении реакции среды в интервале около 2-х единиц рН. Например, у фенолфталеина этот интервал рН от 8,2 до 10,5: при рН=8,2 глаз наблюдает начало появления розовой окраски, которая все усиливается до значения рН=10,5, а при рН=10,5 усиление красной окраски уже незаметно. Этот интервал значений рН, в котором глаз различает изменение окраски индикатора, называют интервалом перехода окраски индикатора. Для метилового оранжевого КД = 1,65·10-4 и рК = 3,8. Это означает, что при рН = 3,8 нейтральная и диссоциированные формы находятся в равновесии в приблизительно равных концентрациях.
Указанный диапазон рН величиной приблизительно в 2 единицы для различных индикаторов не приходится на одну и ту же область шкалы рН, так как его положение зависит от конкретного значения константы диссоциации каждого индикатора: чем более сильная кислота HInd , тем в более кислой области находится интервал перехода индикатора. В табл. 18 приведены интервалы перехода и цвета наиболее распространенных кислотно-основных индикаторов.
Для более точного определения значения pH растворов используют сложную смесь нескольких индикаторов, нанесенную на фильтровальную бумагу (так называемый "Универсальный индикатор Кольтгоффа"). Полоску индикаторной бумаги обмакивают в исследуемый раствор, кладут на белую непромокаемую подложку и быстро сравнивают окраску полоски с эталонной шкалой для pH.
Таблица 18.
Интервалы перехода и окраска в различных средах
наиболее распространенных кислотно-основных индикаторов
| Название | Цвет индикатора в различных средах | ||
| Фенолфталеин | бесцветный рН < 8 | бледно- малиновый 8.0 < pH < 9.8 | малиновый pH > 9.8 |
| Лакмус | красный рН < 5 | фиолетовый 5 < рН < 8 | синий рН > 8 |
| Метиловый оранжевый | красный рН < 3.1 | оранжевый | желтый |
| 3.1< рН < 4.4 | рН > 4.4 | ||
| Метиловый фиолетовый | жёлтый рН = 0 | фиолетовый рН > 3 | |
| Бромкрезоловый зелёный | жёлтый рН < 3,8 | синий рН > 5,6 | |
| Бромтимоловый | жёлтый | синий pH > 7,7 | |
| рН < 6 | |||
| Тимоловый синий | красный рН < 0,5 | жёлтый 2,5 < pH < 7,9 | синий pH > 7,9 |
ГИДРОЛИЗ
Особое место среди обменных реакций занимает гидролиз. В общем случае гидролиз – это разложение веществ водой. Вода – одно из самых активных веществ. Она действует на самые различные классы соединений: соли, углеводы, белки, эфиры, жиры и т. д. При гидролизе соединений неметаллов обычно образуются две кислоты, например:
PCl3 + 3 H2O = H3PO3 + 3 HCl
При этом изменяется кислотность растворов по сравнению с кислотностью растворителя.
В неорганической химии чаще всего приходится иметь дело с гидролизом солей, т.е. с обменным взаимодействием ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды.
Гидролизом солиназывается обратимое взаимодействие ионов соли с ионами воды, приводящее к изменению равновесия между ионами водорода и гидроксида в растворе.
Гидролиз является результатом поляризационного взаимодействия ионов соли с их гидратной оболочкой в водном растворе. Чем значительнее это взаимодействие, тем интенсивнее протекает гидролиз. Упрощенно сущность процесса гидролиза можно представить следующим образом.
Катионы Кn+ связываются в растворе с гидратирующими их молекулами воды донорно-акцепторной связью; донором являются атомы кислорода молекулы воды, имеющие две неподеленные электронные пары, акцептором - катионы, имеющие свободные атомные орбитали. Чем больше заряд катиона и чем меньше его размер, тем значительнее поляризующее действие Кn+ на Н2O.
Анионы Аn‾ связываются с молекулами воды водородной связью. Сильное воздействие анионов может привести к полному отрыву протона от молекулы Н2O – водородная связь становится ковалентной. В результате образуется кислота или анион типа HS‾, НСО3‾ и т. п.
Взаимодействие анионов An‾ с протонами тем значительнее, чем больше заряд аниона и меньше его радиус. Таким образом, интенсивность взаимодействия вещества с водой определяется силой поляризующего влияния Кn+ и Аn‾ на молекулы Н2O. Так, катионы элементов побочных подгрупп и непосредственно следующих за ними элементов подвергаются более интенсивному гидролизу, чем другие ионы одинаковых с ними заряда и радиуса, так как ядра первых менее эффективно экранируются d-электронами.
Гидролиз – процесс обратный реакции нейтрализации. Если реакция нейтрализации процесс экзотермический и необратимый, то гидролиз – процесс эндотермический и обратимый.
Реакция нейтрализации:
2 KOH + H2SO3 → K2SO3 + 2 H2O
сильный слабый сильный слабый
2 OH‾ + H2SO3 = SO32- + 2 H2O
Реакция гидролиза:
K2SO3+ H2O ↔ KOH + KHSO3
SO32- + HOH ↔ HSO3‾ + OH‾
При гидролизе смещается равновесие диссоциации воды вследствие связывания одного из ее ионов (Н+ или ОН-) в слабый электролит соли. При связывании ионов Н+ в растворе накапливаются ионы ОН−, реакция среды будет щелочная, а при связывании ионов ОН− накапливаются ионы Н+ - среда будет кислая.
Различают четыре варианта действия воды на соли.
1. Если катионы и анионы имеют небольшие заряды и большие размеры, то их поляризующее влияние на молекулы воды невелико, т. е. взаимодействие соли с H2O практически не происходит. Это относится к катионам, гидроксиды которых являются щелочами (например, K+ и Са2+) и к анионам сильных кислот (например, Сl‾ и NО3‾). Следовательно, соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. В этом случае равновесие диссоциации воды
H2O ↔ H++ OH‾
в присутствии ионов соли практически не нарушается. Поэтому растворы таких солей нейтральны (pH ≈ 7).
2. Если соль образована катионом сильного основания и анионом слабой кислоты (S2-, CO32-, CN‾ и др.), то происходит гидролиз по аниону. Пример – гидролиз соли СН3СООК. Ионы соли СН3СОО− и К+ взаимодействуют с ионами Н+ и ОН− из воды. При этом ацетат-ионы (СН3СОО−) связываются с ионами водорода (Н+) в молекулы слабого электролита - уксусной кислоты (CH3COOH), а ионы ОН− накапливаются в растворе, сообщая ему щелочную реакцию, так как ионы К+ не могут связать ионы ОН− (КОН является сильным электролитом), pH> 7.
Молекулярное уравнение гидролиза:
СН3СООК + H2O↔КОН + СН3ООН
Полное ионное уравнение гидролиза:
К+ + СН3СОО− + НОН ↔ K+ + ОН− + СН3СООН
сокращенное ионное уравнение гидролиза:
СН3СОО− + НОН ↔ ОН− + СН3СООН
Гидролиз соли Na2S протекает ступенчато. Соль образована сильным основанием (NaOH) и слабой двухосновной кислотой (H2S). В этом случае анион соли S2− связывает ионы Н+ воды, в растворе накапливаются ионы ОН−. Уравнение в сокращенной ионной и молекулярной форме имеет вид:
I. S2− + НОН↔ HS− + ОН−
Na2S + Н2О ↔ NaHS + NaOH
II. HS− + НОН ↔ H2S + ОН−
NaHS + Н2О ↔NaOH + H2S
Вторая ступень гидролиза практически не проходит при обычных условиях, так как, накапливаясь, ионы ОН− сообщают раствору сильнощелочную реакцию, что приводит к реакции нейтрализации, сдвигу равновесия влево в соответствии с принципом Ле Шателье. Поэтому гидролиз солей, образованных сильным основанием и слабой кислотой, подавляется прибавлением щелочи.
Чем больше поляризующее влияние анионов, тем интенсивнее гидролиз. В соответствии с законом действия масс это означает, что гидролиз протекает тем интенсивнее, чем слабее кислота.
3. Если соль образована катионом слабого основания и анионом сильной кислоты, то происходит гидролиз по катиону. Например, это имеет место при гидролизе соли NH4Cl (NH4ОH - слабое основание, НСl - сильная кислота). Отбросим ион Сl−, так как он с катионом воды дает сильный электролит, тогда уравнение гидролиза примет следующий вид:
NH4+ + НОН ↔ NH4OH + Н+ (сокращенное ионное уравнение)
NH4Cl + Н2О ↔ NH4OH + НСl (молекулярное уравнение)
Из сокращенного уравнения видно, что ионы ОН− воды связываются в слабый электролит, ионы Н+ накапливаются в растворе и cреда становится кислой (pH < 7). Добавление кислоты к раствору (введение продукта реакции катионов H+) сдвигает равновесие влево.
Гидролиз соли, образованной многокислотным основанием (например, Zn(NO3)2) протекает ступенчато по катиону слабого основания.
I. Zn2+ + НОН ↔ ZnOH+ + H+(сокращенное ионное уравнение)
Zn(NO3)2 + Н2О ↔ ZnOHNO3 + HNO3 (молекулярное уравнение)
Ионы ОН− связываются в слабое основание ZnOH+, ионы Н+ накапливаются.
Вторая ступень гидролиза практически не происходит при обычных условиях, так как в результате накопления ионов H+ в растворе создается сильнокислая среда и равновесие реакции гидролиза по 2-ой ступени смещено влево:
II. ZnOH+ + НОН ↔ Zn(OH)2 + H+ (сокращенное ионное уравнение)
ZnOHNO3 + Н2О ↔ Zn(OH)2 + HNO3 (молекулярное уравнение)
Очевидно, чем слабее основание, тем полнее идет гидролиз.
4. Соль, образованная катионом слабого основания и анионом слабой кислоты, подвергается гидролизу по катиону и по аниону. Примером служит процесс гидролиза соли СН3СООNH4. Запишем уравнение в ионной форме:
NH4+ + CH3COO− + НОН ↔ NH4OH + СН3СООН
Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и слабое основание, и слабая кислота.
Реакция среды в этом случае зависит от сравнительной силы основания и кислоты, т.е. от их констант диссоциации (KД):
─ если KД (основания) > KД (кислоты) , то pH > 7;
─ если KД (основания) < KД (кислоты), то pH < 7.
В случае гидролиза CH3COONH4:
KД (NH4OH) = 1,8·10-5; KД (CH3COOH)=1,8·10-5,
поэтому реакция водного раствора этой соли будет почти нейтральной (pH ≈ 7).
Если основание и кислота, образующие соль, являются не только слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то в этом случае гидролиз соли протекает по всем ступеням до конца, т.е. до образования слабого труднорастворимого основания и слабой кислоты. В этом случае речь идет о необратимом или полном гидролизе.
Именно полный гидролиз является причиной того, что водные растворы некоторых солей приготовить нельзя, например Сr2(CO3)3, Al2S3 и др. Например:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Поэтому сульфид алюминия не может существовать в виде водных растворов, может быть получен только "сухим способом", например, из элементов при высокой температуре:
2Al + 3S –t°→ Al2S3,
и должен храниться в герметических сосудах, исключающих попадание влаги.
Реакцией обмена в водном растворе такие соединения нельзя получить. При взаимодействии солей А13+, Сr3+ и Fe3+ в растворе с сульфидами и карбонатами в осадок выпадают не сульфиды и карбонаты этих катионов, а их гидроксиды:
2AlCl3 +3Na2S +6Н2О → 3Н2S↑ + 2Аl(ОН)3↓ +6NaCl
2CrCl3 + 3Na2CO3 + 3H2O → 2Сr(ОН)3↓ + 3СO2↑ + 6NaCl
В рассмотренных примерах происходит взаимное усиление гидролиза двух солей (АlСl3 и Na2S или СrСl3 и Nа2СО3) и реакция идет до конца, так как продукты реакции выделяются из раствора в виде осадка и газа.
Гидролиз солей в ряде случаев может протекать очень сложно. (Простые уравнения реакции гидролиза в общепринятой записи часто являются условными.) Продукты гидролиза можно установить лишь на основании аналитического исследования. К примеру, продуктами гидролиза солей, содержащих многозарядные катионы, могут быть полиядерные комплексы. Так, если в раствоpax Hg2+ содержатся только одноядерные комплексы, то в растворах Fe3+ помимо комплексов [FeOH]2+ и [Fe(OH)2]+ обнаруживается двухъядерный комплекс [Fe2(OH)2]4+; в растворах Ве2+ в основном образуются многоядерные комплексы состава [Ве3(OH)3]3+; в растворах Sn2+ образуются комплексные ионы [Sn3(OH)4]2+, [Sn2(OH)2]2+, [SnOH]+; в растворах Bi3+ наряду с [ВiOН]2+ находятся комплексные ионы состава [Bi6(OH)12]6+. Реакции гидролиза, приводящие к образованию полиядерных комплексов, можно представить следующим образом:
mMk+ + nH2О ↔ Мm(OН)n(mk - n)+ + nН+,
где m изменяется от 1 до 9, а n может принимать значения от 1 до 15. Такого рода реакции возможны для катионов более чем 30 элементов. Установлено, что каждому заряду иона в большинстве случаев отвечает определенная форма комплекса. Так, для ионов М2+ характерна форма димеров [M2(OH)]3+, для ионов М3+ – [M2(OH)2]4+, а для М4+ – форма [M2(OH)3]5+ и более сложные, например [Zr4(OH)8]8+ .
При высоких температурах и больших значениях рН образуются и оксокомплексы:
2MOH ↔ MOM + H2O или

Например,
BiCl3 + H2O « Bi(OH)2Cl + 2HCl
Катион Bi(OH)2+ легко теряет молекулу воды, образуя катион висмутила ВiO+, который с хлорид-ионом дает белый кристаллический осадок:
Bi(OH)2Cl ®BiOCl↓ + H2O.
Структурно полиядерные комплексы можно представить в виде октаэдров, соединенных между собой по вершине, ребру или грани посредством различных мостиков (О, ОН и др.).
Сложный состав имеют продукты гидролиза карбонатов ряда металлов. Так, при взаимодействии растворимых солей Mg2+, Cu2+, Zn2+, Рb2+ с карбонатом натрия образуются не средние карбонаты, а менее растворимые гидроксокарбонаты, например Сu2(ОН)2СО3, Zn5(ОН)6(СО3)2, Рb3(ОН)2(СО3)2. В качестве примера можно привести реакции:
5MgSO4 + 5Na2CO3 + Н2O → Мg5(ОН)2(СО3)4↓ + 5Na2SO4 + СO2↑
2Cu(NO3)2 + 2Na2CO3 + H2O → Cu2(OH)2CO3↓ + 4NaNO3 + CO2↑
Количественно гидролиз характеризуется степенью гидролиза h и константой гидролиза КГ.
Степень гидролиза показывает, какая часть соли, содержащаяся в растворе (СМ), подверглась гидролизу (СМгид) и рассчитывается как отношение:
h=СМ гид / СМ (100%).
Очевидно, что для обратимого процесса гидролиза h < 1 (<100%), а для необратимого гидролиза h = 1 (100%). Кроме природы соли, степень гидролиза зависит от концентрации соли и температуры раствора.
В растворах с умеренной концентрацией растворенного вещества степень гидролиза при комнатной температуре обычно невелика. Для солей, образованных сильным основанием и сильной кислотой, она практически равна нулю; для солей, образованных слабым основанием и сильной кислотой или сильным основанием и слабой кислотой, она составляет ≈ 1%. Так, для 0,01 М раствора NH4Cl h = 0,01%; для 0,1 н. раствора CH3COONH4 h ≈ 0,5%.
Гидролиз – процесс обратимый, поэтому к нему применим закон действующих масс.
Константа гидролиза есть константа равновесия процесса гидролиза, и по своему физическому смыслу определяет степень необратимости гидролиза. Чем больше КГ, тем необратимее гидролиз. КГ имеет свое выражение для каждого случая гидролиза.
Выведем выражение для константы гидролиза соли слабой кислоты и сильного основания на примере NaCN:
NaCN + H2O ↔ NaOH + HCN;
Na++ CN–+H2O ↔ Na++ OH–+ HCN;
CN–+ H2O ↔ HCN + OH–
Кравн = [HCN][OH–] / [CN–][H2O].
[H2O] имеет наибольшую величину, которая в ходе реакции практически не изменяется, поэтому ее можно условно считать постоянной. Тогда помножив числитель и знаменатель на концентрацию протонов и введя постоянную концентрацию воды в константу, получим:
Кравн [H2O] = KW / КД(кисл) = KГ
так как [HCN] / [H+][CN–] = 1/ КД(кисл)
Поскольку KWвеличина постояннаяи равна 10-14 , очевидно, что чем меньше КД слабой кислоты, анион которой входит в состав соли, тем больше KГ.
Аналогично, для соли, гидролизующейся по катиону (например NH4Cl), получим:
NH4+ + H2O ↔ NH4OH + H+ (сокращенное уравнение гидролиза)
Кравн = [NH4OH][H+] / [NH4+][H2O]
KГ = Кравн [H2O] = KW / КД(осн)
В этом выражении числитель и знаменатель дроби умножили на [OH–]. Очевидно, что чем меньше КД слабого основания, катион которого входит в состав соли, тем больше KГ.
Если соль образована слабым основанием и слабой кислотой (на примере NH4CN), то сокращенное уравнение гидролиза имеет вид:
NH4+ + CN–+ H2O ↔ NH4OH + HCN
Кравн = [NH4OH] [HCN] / [NH4+][CN–],
В этом выражении для Кравн числитель и знаменатель дроби умножаем на [H+]·[OH–], поэтому выражение для KГ принимает вид:
KГ = KW / (КД(кислоты) КД(осн)).
Как следует из приведенных выражений, константа гидролиза обратно пропорциональна константе диссоциации слабого электролита, участвующего в образовании соли (если в образовании соли участвуют два слабых электролита, то KГ обратно пропорциональна произведению их констант диссоциации).
Рассмотрим гидролиз многозарядного иона. Возьмем Na2CO3.
I. CO32- + H2O « HCO3–+ OH–
KГ(I) = [HCO3–][OH–] / [CO32-][H2O] × ([H+] / [H+]) = KW / КД(II),
то есть в выражение для константы гидролиза по первой ступени в знаменатель входит вторая константа диссоциации, и для второй ступени гидролиза
II. HCO3–+ H2O « H2CO3+ OH–
KГ(II) = [H2CO3][OH–] / [HCO3–][H2O] × ([H+] / [H+]) = KW / КД(I)
KД(I) = 4×10-7 KД(II) = 2.5×10-8
KГ(II) = 5.6×10-11 KГ(I) = 1.8×10-4
Таким образом, KГ(I) >> KГ(II), константа, а следовательно, и степень первой стадии гидролиза много больше последующих.
Степень гидролиза является величиной аналогичной степени диссоциации. Взаимосвязь степени и константы гидролиза аналогична таковой для степени и константы диссоциации.
Если в общем случае исходную концентрацию аниона слабой кислоты обозначить через Со (моль/л), то Соh (моль/л) – концентрация той части аниона A–, которая подверглась гидролизу и образовалось Соh (моль/л) слабой кислоты HA и Соh (моль/л) гидроксидных групп.
A– + H2O ↔ HA + OH–,
Со-Соh Соh Соh
тогда KГ = [HA][OH–] / [A–] = Соh·Соh / (Со-Соh) = Соh2 / (1-h).
 При h << 1 KГ = Соh2 h = √КД / Со.
При h << 1 KГ = Соh2 h = √КД / Со.
Очень похоже на закон разбавления Оствальда.
Можно рассчитать pH раствора, если известны Со и h. Учитывая, что
[HA] = [OH–] = Соh, получим:
 KГ = Соh·Соh / Со = [OH–]2/ Со, откуда
KГ = Соh·Соh / Со = [OH–]2/ Со, откуда
[OH–] = √КГ·Со.
Аналогично, можно показать, что при гидролизе по катиону
 [H+] = √КГ·Со.
[H+] = √КГ·Со.
Таким образом, способность солей подвергаться гидролизу зависит от двух факторов:
─ свойств ионов, образующих соль;
─ внешних факторов.
Как сдвинуть равновесие гидролиза?
1) Добавление одноименных ионов. Поскольку при обратимом гидролизе устанавливается динамическое равновесие, то в соответствии с законом действия масс равновесие можно сместить в ту или иную сторону введением в раствор кислоты или основания. Введение кислоты (катионов Н+) подавляет гидролиз по катиону, добавление щелочи (анионов OH–) подавляет гидролиз по аниону. Этим часто пользуются для усиления или подавления процесса гидролиза.
2) Из формулы для h видно, что разбавление способствует гидролизу. Рост степени гидролиза карбоната натрия
Na2CO3 + НОН ↔ NaHCO3 + NaOH
при разбавлении раствора иллюстрирует рис. 20.
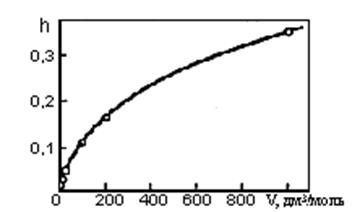
Рис. 20. Зависимость степени гидролиза Na2CO3 от разбавления при 20°С
3) Повышение температуры способствует гидролизу. Константа диссоциации воды увеличивается при повышении температуры в большей степени, чем константы диссоциации продуктов гидролиза - слабых кислот и оснований, поэтому при нагревании степень гидролиза возрастает. К этому выводу легко прийти и иначе: так как реакция нейтрализации экзотермична (DH= –56 кДж/моль), то гидролиз, будучи противоположным ей процессом, эндотермичен, поэтому в соответствии с принципом Ле Шателье нагревание вызывает усиление гидролиза. Рис. 21 иллюстрирует влияние температуры на гидролиз хлорида хрома (III)
СrСl3 + НОН ↔ CrOHCl2 + НСl

Рис. 21. Зависимость степени гидролиза СrСl3 от температуры
В химической практике весьма распространен гидролиз по катиону солей, образованных многозарядным катионом и однозарядным анионом, например АlС13. В растворах этих солей менее диссоциированное соединение образуется в результате присоединения одного гидроксид-иона к иону металла. Учитывая, что ион Аl3+ в растворе гидратирован, первую стадию гидролиза можно выразить уравнением
[Al(H2O)6]3+ + HOH ↔ [Al(H2O)5OH]2+ + H3O+
При обычной температуре гидролиз солей многозарядных катионов практически ограничивается этой стадией. При нагревании происходит гидролиз по второй ступени:
[Al(H2O)5OH]2+ + HOH ↔ [Al(H2O)4(OH)2]+ + H3O+
Таким образом, кислая реакция водного раствора соли объясняется тем, что гидратированный катион теряет протон и аквагруппа Н2O превращается в гидроксогруппу ОН‾. В рассмотренном процессе могут образоваться и более сложные комплексы, например [Al6(OH)15]3+, а также комплексные ионы вида [AlO(OH)4]3- и [АlO2(ОН)2]3-. Содержание различных продуктов гидролиза зависит от условий проведения реакции (концентрация раствора, температура, присутствие других веществ). Имеет значение также длительность протекания процесса, так как равновесие при гидролизе солей многозарядных катионов обычно достигается медленно.
БУФЕРНЫЕ РАСТВОРЫ
В лабораторной практике часто требуется применять растворы с вполне определенным и постоянным значением рН. Очень разбавленные растворы кислот или щелочей с постоянным значением рН нельзя получить путем разбавления растворов сильных кислот или оснований, так как незначительные количества СO2 из воздуха, щелочей из стекла посуды или незначительных примесей кислотного или основного характера в дистиллированной воде могут заметно изменить реакцию растворов.
Проблема поддержания постоянного значения рН особенно остро стоит в биологических системах. В различных органах живого организма рН поддерживается с точностью до десятых долей. Как это достигается, если постоянно идут какие-то процессы, хотя бы уже упомянутое поглощение СО2 из воздуха?
Растворы, обладающие способностью сохранять определенное значение pН, готовят смешиванием слабых кислот или слабых оснований с их солями.
Растворы слабой кислоты и ее соли (или слабого основания и его соли), концентрация водородных ионов в которых почти не меняется при введении в них сильной кислоты или сильного основания, а также при разбавлении, называются буферными растворами.
Рассмотрим раствор, содержащий слабую кислоту ( уксусную, например) и ее соль. В растворе происходит полная диссоциация соли и частичная - слабой кислоты
CH3COOH « CH3COO‾ + H+
CH3COONa → CH3COO‾ + Na+ нацело
Уксусная кислота – кислота слабая ( КД=1,8·10-5). Выражение для константы диссоциации имеет вид:

Отсюда следует:
[Н+] = K [СН3СООН] / [СН3СОO‾]
В чистом 0,1М растворе легко подсчитать концентрацию водородных ионов
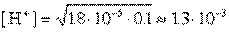 моль/л
моль/л
При введении в раствор хорошо диссоциирующего ацетата натрия диссоциация кислоты подавляется, т.е. [H+] стала еще меньше. В результате этого концентрация недиссоциированных молекул СН3СООН становится почти равной общей концентрации кислоты (Ca), а концентрация ионов СН3СОО‾ – общей концентрации соли (Сs). Тогда

–lg [Н+] = –lg K + lg (Сs / Ca)
pH = pK + lg (Сs / Ca).
Эти формулы показывают, что pH буферного раствора зависит от константы диссоциации кислоты и соотношения аналитических концентраций соли и кислоты (более точные расчеты должны проводиться с использованием не концентраций, а активностей).
Так как константа диссоциации при данных условиях - постоянная величина, то концентрация водородных ионов в таком растворе определяется только соотношением концентраций кислоты и ее соли и не зависит от абсолютного значения концентраций. Поэтому разбавление этого раствора практически не изменит его рН.
Буферное действие подобных растворов основано на следующих процессах. Если к ацетатному буферному раствору [СН3СООН + NаСН3СОО] прибавить в пределах буферной емкости раствор щелочи (NaOH или КОН), то будет происходить нейтрализация гидроксида слабой кислотой:
СН3СООН + ОН‾ = СН3СОО‾ + Н2О.
При добавлении к ацетатному буферному раствору сильной кислоты ионы водорода связываются анионами слабой кислоты, образующейся при диссоциации соли:
Н+ + СН3СОО‾ = СН3СООН.
Таким образом, в результате связывания гидроксид-ионов или ионов водорода, возникающих при добавлении сильного основания или сильной кислоты, рН буферного раствора практически не изменяется. Так, при добавлении в 1л 0,1М ацетатного буферного раствора, а для сравнения и в воду 0,01 моль соляной кислоты или гидроксида натрия рН растворов принимает значения, приведенные в табл. 18.
Способность раствора поддерживать определенное значение рН называется буферным действием.
Таблица 18.
Изменение рН в чистой воде и в растворе ацетатного буфера
при добавлении кислоты и щелочи (на 1 л раствора)
| Добавленное вещество | Значение рН | |
| воды | ацетатного буферного раствора | |
| – | 4,65 | |
| 0,01 моль HCl | 4,56 | |
| 0,01 моль NaOH | 4,73 |
Буферное действие раствора измеряется буферной емкостью, т.е. тем количеством щелочи или кислоты, которое требуется прибавить к 1 л раствора, чтобы значение его рН изменилось на единицу.
Максимальная буферная емкость наблюдается у тех растворов, которые содержат равные концентрации слабой кислоты и ее соли, или слабого основания и его соли. Буферная емкость раствора тем больше, чем выше концентрация компонентов буферной смеси.
Наиболее часто встречающиеся буферные системы (в том числе и в биологических объектах): СH3COOH/СH3COONa – ацетатный буфер, NH4OH/ NH4Cl – аммиачный буфер, Na2CO3/ NaHCO3 – карбонатный буфер, HCOOH/ HCOONa – формиатный буфер, Na2HPO4/NaH2PO4 – фосфатный буфер и т.д.
Интересным примером буферного раствора является тетраборат натрия (бура) Na2B4O7·10H2O, который дает буферный раствор с pH 9,1 благодаря гидролизу:
Na2B4O7 + 7 H2O = 2Na[B(OH)4] + 2H3BO3
Высокое значение pH объясняется исключительной слабостью борной кислоты.
В биохимии при различных манипуляциях с растворами белков широко применяются буферные растворы tris-HCl, так как в них поддерживается близкая к нейтральной реакция среды. При этом исключается возможность денатурации белков из-за резкого повышения или понижения pH. Tris – трис(гидроксиметиламинометан):
