 |
|
КОНТРОЛЬНЫЕ Задания для самостоятельноЙ РАБОТЫ
Адача 1
Рассчитайте:
а) массовую растворенного вещества;
б) молярную концентрацию растворенного вещества;
в) молярную концентрацию эквивалентов;
г) моляльность;
д) мольную долю растворенного вещества и растворителя;
е) титр раствора,
если:
1.1. В воде объемом 100 мл растворили 0,125 моль йодноватой кислоты  . Плотность полученного раствора
. Плотность полученного раствора 
1,174 г/мл.
1.2. В воде массой 172,8 г растворили газообразный аммиак массой 19,2 г и получили нашатырный спирт, плотность которого равна  0,96 г/мл.
0,96 г/мл.
Растворенное вещество - гидроксид аммония  .
.
1.3. В 2350 г раствора нитрата железа (III) плотностью  1,175 г/мл содержится
1,175 г/мл содержится  в количестве 1,95 моль.
в количестве 1,95 моль.
1.4. В 2 л раствора гидроксида кальция содержится 478,8 г  . Плотность раствора
. Плотность раствора  1,14 г/мл.
1,14 г/мл.
1.5. Растворимость сульфата алюминия при 20 oС равна 36.4 г 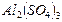 в 100 г воды. Плотность насыщенного раствора
в 100 г воды. Плотность насыщенного раствора 
1,32 г/мл.
1.6. В 640 мл воды растворили 160 г хлорида железа (III)  . Плотность полученного раствора составляет
. Плотность полученного раствора составляет  1,032 г/мл.
1,032 г/мл.
1.7. Из 108 г воды и 27 г сульфата железа (II) приготовили раствор, объем которого составил 111,2 мл.
1.8. В растворе ортофосфорной кислоты массой 1200 г и плотностью  1,153 г/мл содержится 312 г
1,153 г/мл содержится 312 г  .
.
1,9. В растворе нитрата натрия объемом 300 мл и плотностью  1,01 г/мл содержится 0,06 моль
1,01 г/мл содержится 0,06 моль  .
.
1.10. В 85,6 мл воды растворили 1,07 моль плавиковой кислоты  . Плотность полученного раствора
. Плотность полученного раствора  1,070 г/мл.
1,070 г/мл.
1.11. В 335 г раствора хлорида олова (II) с плотностью  1,415 г/мл содержится 135 г хлорида олова (II)
1,415 г/мл содержится 135 г хлорида олова (II) 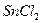 .
.
1.12. В растворе хлорида кальция объемом 200 мл и плотностью  1,12 г/мл содержится 0,28 моль хлорида кальция
1,12 г/мл содержится 0,28 моль хлорида кальция  .
.
1.13. В 5,6 л воды растворили 30 моль нитрата аммония  . Плотность полученного раствора
. Плотность полученного раствора  1,128 г/мл.
1,128 г/мл.
1.14. Из 156,2 г воды и 88,0 г азотной кислоты  приготовили раствор азотной кислоты объемом 200 мл.
приготовили раствор азотной кислоты объемом 200 мл.
1.15. В растворе сульфата железа (III) объемом 800 мл и плотностью  1,181 г/мл содержится 189 г
1,181 г/мл содержится 189 г  .
.
1.16. В 2450 г раствора сульфата натрия, плотность которого  1,115 г/мл, содержится 3,14 моль
1,115 г/мл, содержится 3,14 моль  .
.
1.17. В 100 мл воды растворили 25 г бромида натрия  и получили раствор с плотностью
и получили раствор с плотностью  1,175 г/мл.
1,175 г/мл.
1.18. Из 4568 г воды и 1612 г гидроксида калия  приготовили раствор с плотностью
приготовили раствор с плотностью  1,24 г/мл.
1,24 г/мл.
1.19. В 150 г раствора сульфата аммония, плотность которого  1,057 г/мл, содержится 1,5 г сульфата аммония
1,057 г/мл, содержится 1,5 г сульфата аммония  .
.
1.20. В растворе сульфата хрома (III) объемом 1800 мл и плотностью  1,096 г/мл содержится 0,5 моль сульфата
1,096 г/мл содержится 0,5 моль сульфата
хрома (III)  .
.
1.21. Из 15 г хлорида алюминия  и 135 г воды приготовили раствор с плотностью
и 135 г воды приготовили раствор с плотностью  1,090 г/мл.
1,090 г/мл.
1.22. В растворе хлорида лития массой 1700 г и плотностью  1,254 г/мл содержится 16 моль
1,254 г/мл содержится 16 моль  .
.
1.23. В воде объемом 1040 мл растворили 260 г нитрита натрия  . Плотность полученного раствора
. Плотность полученного раствора  1,137 г/мл.
1,137 г/мл.
1.24. Раствор нитрата меди (II) объемом 400 мл содержит
8,12 г  . Плотность раствора
. Плотность раствора  1,015 г/мл.
1,015 г/мл.
1.25. Растворив 112,2 г нитрата цинка  в 175,4 мл воды, получили 200 мл раствора.
в 175,4 мл воды, получили 200 мл раствора.
Задача 2
2.1. Для раствора нитрата стронция  с плотностью
с плотностью  1,048 г/мл и титром 0,0636 г/мл рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, моляльность, мольную долю растворенного вещества.
1,048 г/мл и титром 0,0636 г/мл рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, моляльность, мольную долю растворенного вещества.
2.2. Для раствора сульфата лития с массовой долей  0,1 и плотностью
0,1 и плотностью  1,086 г/мл рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
1,086 г/мл рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
2.3. Молярность раствора карбоната калия  с плотностью
с плотностью  1,414 г/мл равна 4,1 моль/л. Рассчитайте: массовую долю
1,414 г/мл равна 4,1 моль/л. Рассчитайте: массовую долю  , молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
2.4. Для 3,95 н. раствора хлорида аммония  , плотность которого
, плотность которого  1,056 г/мл, рассчитайте: массовую долю, молярную концентрацию, титр, моляльность, мольную долю растворенного вещества.
1,056 г/мл, рассчитайте: массовую долю, молярную концентрацию, титр, моляльность, мольную долю растворенного вещества.
2.5. Для раствора хлорида цинка  плотностью
плотностью 
1,292 г/мл, титр которого равен 0,3876, рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, моляльность, мольную долю растворенного вещества.
2.6. Для 0,736 m раствора сульфата марганца (II)  плотностью
плотностью  1,102г/мл рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю растворенного вещества.
1,102г/мл рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю растворенного вещества.
2.7. Молярная концентрация эквивалентов в растворе хлорида калия  плотностью
плотностью  1,023 г/мл равна 0,55. Рассчитайте: молярную концентрацию, массовую долю, моляльность, титр, мольную долю растворенного вещества.
1,023 г/мл равна 0,55. Рассчитайте: молярную концентрацию, массовую долю, моляльность, титр, мольную долю растворенного вещества.
2.8. Рассчитайте для 0,7 М раствора хлорида натрия  с плотностью
с плотностью  1,026 г/мл: массовую долю, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
1,026 г/мл: массовую долю, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
2.9. Плотность водного раствора соды, массовая доля  в котором составляет 6 %, равна
в котором составляет 6 %, равна  1,060 г/мл. Рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
1,060 г/мл. Рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
2.10. Плотность 1,071 m раствора сульфата железа (III) равна  1,307 г/мл. Рассчитайте: массовую долю
1,307 г/мл. Рассчитайте: массовую долю  , молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю растворенного вещества.
, молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю растворенного вещества.
2.11. Плотность водного 20 %-го (по массе) раствора нитрата серебра  равна 1,194 г/мл. Рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
равна 1,194 г/мл. Рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
2.12. Массовая доля сульфата алюминия 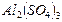 в растворе плотностью
в растворе плотностью  1,019 г/мл равна 0,06. Рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
1,019 г/мл равна 0,06. Рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
2.13. В растворе хлорида бария плотностью  1,034 г/мл молярная концентрация эквивалентов
1,034 г/мл молярная концентрация эквивалентов  равна 0,4 моль/л. Рассчитайте: молярную концентрацию, массовую долю, моляльность, титр, мольную долю растворенного вещества.
равна 0,4 моль/л. Рассчитайте: молярную концентрацию, массовую долю, моляльность, титр, мольную долю растворенного вещества.
2.14. Для раствора бихромата калия  плотностью
плотностью  1,026 г/мл, моляльная концентрация которого равна
1,026 г/мл, моляльная концентрация которого равна
0,142 моль/кг, рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю растворенного вещества.
2.15. Титр раствора бромида калия  с плотностью
с плотностью
1,074 г/мл равен 0,1071. Рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, моляльность, мольную долю растворенного вещества.
2.16. Плотность водного 0,31 М раствора хлорида алюминия  равна 1,034 г/мл. Рассчитайте: маcсовую долю, молярную концентрацию эквивалентов, титр, моляльность, мольную долю растворенного вещества.
равна 1,034 г/мл. Рассчитайте: маcсовую долю, молярную концентрацию эквивалентов, титр, моляльность, мольную долю растворенного вещества.
2.17. Для 0,4 М раствора сульфата меди (II)  с плотностью
с плотностью  1,062 г/мл рассчитайте: массовую долю, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
1,062 г/мл рассчитайте: массовую долю, молярную концентрацию эквивалентов, моляльность, титр, мольную долю растворенного вещества.
2.18. Плотность 2,4 н. раствора нитрата свинца (II) равна
1,328 г/мл. Рассчитайте: массовую долю, молярную концентрацию, моляльность, титр, мольную долю  в растворе.
в растворе.
2.19. Моляльность раствора хлорида железа (III) плотностью  1,015 г/мл равна 0,126. Рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю
1,015 г/мл равна 0,126. Рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю  в растворе.
в растворе.
2.20. Для раствора перманганата калия плотностью 
1,027 г/мл титр равен 0,0411. Рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов  , моляльность, мольную долю
, моляльность, мольную долю 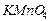 в растворе.
в растворе.
2.21. Для 8%-го раствора иодида калия 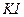 с плотностью
с плотностью  1,059 г/мл ввчислите: молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю растворенного вещества.
1,059 г/мл ввчислите: молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю растворенного вещества.
2.22. Молярная концентрация раствора ортофосфорной кислоты с плотностью  1,153 г/мл равна З,06 моль/л. Рассчитайте: массовую долю, молярную концентрацию эквивалентов, моляльность, титр, мольную долю
1,153 г/мл равна З,06 моль/л. Рассчитайте: массовую долю, молярную концентрацию эквивалентов, моляльность, титр, мольную долю  в растворе.
в растворе.
2.23. Нормальная концентрация раствора сульфата никеля (II) плотностью  1,085 г/мл равна 1,12. Рассчитайте: массовую долю, молярную концентрацию, моляльность, титр, мольную долю
1,085 г/мл равна 1,12. Рассчитайте: массовую долю, молярную концентрацию, моляльность, титр, мольную долю  в растворе.
в растворе.
2.24. Для раствора хлорида марганца (II) плотностью  1,298 г/мл и моляльностью 3,4 рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю
1,298 г/мл и моляльностью 3,4 рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, титр, мольную долю  в растворе.
в растворе.
2.25. Плотность раствора хромата калия, имеющего титр 0,0854, равна 1,064 г/мл. Рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, моляльность, мольную долю 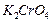 в растворе.
в растворе.
Задача 3
3.1. Какой объем концентрированного раствора едкого натра с массовой долей  0,234 и плотностью
0,234 и плотностью  1,260 г/мл и воды потребуется для приготовления 500 мл 1 М раствора
1,260 г/мл и воды потребуется для приготовления 500 мл 1 М раствора  (
(  1,042 г/мл)?
1,042 г/мл)?
3.2. Какой объем 0,3 н. раствора хлорида меди (II) ( 
1,017 г/мл) можно получить из 75 мл 2,47 М раствора  (
(  1,278 г/мл)? Рассчитайте массу растворенного вещества и воды в приготовленном растворе.
1,278 г/мл)? Рассчитайте массу растворенного вещества и воды в приготовленном растворе.
3.3. Какой объем воды необходимо добавить к 45 мл концентрированного 20 %-го (по массе) раствора сульфата хрома (III) (  1,222 г/мл), чтобы получить 0,106 М раствор (
1,222 г/мл), чтобы получить 0,106 М раствор ( 
1,039 г/мл)? Рассчитайте массовую долю  в полученном растворе.
в полученном растворе.
3.4. К 100, мл 3,3 н. раствора нитрата алюминия ( 
1,175 г/мл) добавили 350 мл воды. Определите массовую долю  и молярную концентрацию приготовленного раствора (
и молярную концентрацию приготовленного раствора (  1,039 г/мл).
1,039 г/мл).
3.5. Какой объем 63 %-го (по массе) раствора азотной кислоты (  1,38 г/мл) и воды потребуется для приготовления 5 л 2 н. раствора
1,38 г/мл) и воды потребуется для приготовления 5 л 2 н. раствора  (
(  1,066 г/мл)?
1,066 г/мл)?
3.6. Какой объем раствора с массовой долей 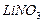 0,04 (
0,04 (  1,029 г/мл) можно получить из 25 мл 4,4 М раствора нитрата лития (
1,029 г/мл) можно получить из 25 мл 4,4 М раствора нитрата лития (  1,169 г/мл)? Рассчитайте моляльную концентрацию разбавленного раствора.
1,169 г/мл)? Рассчитайте моляльную концентрацию разбавленного раствора.
3.7. Какой объем воды необходимо добавить к 45 мл раствора хлорной кислоты с массовой долей  18 % и плотностью
18 % и плотностью  1,113 г/мл, чтобы получить 10 %-й (по массе) раствор кислоты (
1,113 г/мл, чтобы получить 10 %-й (по массе) раствор кислоты (  1,060 г/мл). Рассчитайте молярную концентрацию полученного раствора.
1,060 г/мл). Рассчитайте молярную концентрацию полученного раствора.
3.8. К 230 мл 1,53 М раствора сульфата цинка (  1,232 г/мл) добавили 500 мл воды. Для приготовленного раствора (
1,232 г/мл) добавили 500 мл воды. Для приготовленного раствора ( 
1,073 г/мл) рассчитайте массовую долю  и молярную концентрацию эквивалентов.
и молярную концентрацию эквивалентов.
3.9. Какой объем 1,29 М раствора нитрата кобальта (II) (  1,184 г/мл) и воды потребуется для приготовления 200 мл
1,184 г/мл) и воды потребуется для приготовления 200 мл
5 %-го (по массе) раствора  (
(  1,041 г/мл)?
1,041 г/мл)?
3.10. Какой объем 0,33 М раствора нитрата свинца ( 
1,094 г/мл) можно получить из 35 мл 1,21 М раствора  (
(  1,336 г/мл). Рассчитайте массовую долю растворенного вещества в полученном растворе.
1,336 г/мл). Рассчитайте массовую долю растворенного вещества в полученном растворе.
3.11. Какой объем воды следует добавить к 100 мл 1,37 М раствора бромида хрома (III) (  1,34 г/мл), чтобы получить раствор с массовой долей
1,34 г/мл), чтобы получить раствор с массовой долей  0,06 (
0,06 (  1,05 г/мл). Рассчитайте молярную концентрацию эквивалентов для получения раствора.
1,05 г/мл). Рассчитайте молярную концентрацию эквивалентов для получения раствора.
3.12. К 5 мл 30 %-го (по массе) раствора пероксида водорода  (
(  1,1122 г/мл) прилили 50 мл воды. Рассчитайте массовую долю
1,1122 г/мл) прилили 50 мл воды. Рассчитайте массовую долю  и молярную концентрацию полученного раствора (
и молярную концентрацию полученного раствора (  1,0095 г/мл).
1,0095 г/мл).
3.13. Какой объем концентрированного 0,98 М раствора бромида алюминия (  1,193 г/мл) и воды потребуется для приготовления 200 мл раствора с массовой долей
1,193 г/мл) и воды потребуется для приготовления 200 мл раствора с массовой долей  0,04 (
0,04 ( 
1,029 г/мл)?
3.14. Какой объем раствора с массовой долей  0,04 (
0,04 (  1,0107 г/мл) можно приготовить из 150 мл 22 %-го (по массе) раствора хлорида аммония (
1,0107 г/мл) можно приготовить из 150 мл 22 %-го (по массе) раствора хлорида аммония (  1,0621 г/мл)? Рассчитайте молярную концентрацию полученного раствора.
1,0621 г/мл)? Рассчитайте молярную концентрацию полученного раствора.
3,15. Какой объем воды необходимо добавить к 400 мл 3,7 н. раствора хлорида кобальта (II) (  1,20 г/мл), чтобы получить раствор, молярность которого равна 0,49 (
1,20 г/мл), чтобы получить раствор, молярность которого равна 0,49 (  1,055 г/мл). Рассчитайте массовую долю
1,055 г/мл). Рассчитайте массовую долю 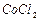 в полученном растворе.
в полученном растворе.
3.16. К 15 мл раствора сульфата кадмия с массовой долей  0,1 и плотностью
0,1 и плотностью  1,102 г/мл прилили 25 мл воды. Рассчитайте молярную концентрацию и массовую долю
1,102 г/мл прилили 25 мл воды. Рассчитайте молярную концентрацию и массовую долю  в приготовленном растворе (
в приготовленном растворе (  1,038 г/мл).
1,038 г/мл).
3.17. Какой объем 1 М раствора хлорида хрома (III) (  1,1316 г/мл) необходимо взять для приготовления 0,3 л
1,1316 г/мл) необходимо взять для приготовления 0,3 л
0,385 н. раствора  (
(  1,0166 г/мл)? Определите массовую долю
1,0166 г/мл)? Определите массовую долю  в приготовленном растворе.
в приготовленном растворе.
3.18. Какой объем 0,6 н. раствора сульфата калия ( 
1,039 г/мл) можно получить из 150 мл 10 %-го (по массе) раствора  (
(  1,081 г/мл). Рассчитайте массу вещества и воды в приготовленном растворе.
1,081 г/мл). Рассчитайте массу вещества и воды в приготовленном растворе.
3.19. Какой объем воды необходимо добавить к 145 мл 6,8 М раствора бромоводородной кислоты  (
(  1,37 г/мл), чтобы получить 0,51 н. раствор (
1,37 г/мл), чтобы получить 0,51 н. раствор (  1,028 г/мл)? Рассчитайте титр полученного раствора.
1,028 г/мл)? Рассчитайте титр полученного раствора.
3.20. К 185 мл 3,24 н. раствора хлорида бериллия ( 
1,080 г/мл) прилили 400 мл воды. Для приготовленного раствора рассчитайте массовую долю 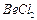 и моляльность.
и моляльность.
3.21. Какой объем 1,63 М раствора нитрата хрома (III) (  1,293 г/мл) требуется для приготовления 250 мл 0,22 М раствора
1,293 г/мл) требуется для приготовления 250 мл 0,22 М раствора  (
(  1,041 г/мл)? Рассчитайте массовую долю
1,041 г/мл)? Рассчитайте массовую долю  в исходном и полученном растворах.
в исходном и полученном растворах.
3.22. Какой объем 8 %-го (по массе) раствора (  1,049 г/мл) нитрата калия можно получить из 0,1 л раствора с массовой долей
1,049 г/мл) нитрата калия можно получить из 0,1 л раствора с массовой долей  0,2 и плотностью
0,2 и плотностью  1,133 г/мл? Рассчитайте моляльность приготовленного раствора.
1,133 г/мл? Рассчитайте моляльность приготовленного раствора.
3.23. К 36 мл 0,676 М раствора ортофосфата натрия (  1,1083 г/мл) прилили 10 мл воды. Рассчитайте массовую долю
1,1083 г/мл) прилили 10 мл воды. Рассчитайте массовую долю  и титр приготовленного раствора (
и титр приготовленного раствора (  1,085 г/мл).
1,085 г/мл).
3.24. Какой объем раствора с массовой долей нитрата цезия
2 % (  1,014 г/мл) можно приготовить из 10 мл 0,55 н. раствора
1,014 г/мл) можно приготовить из 10 мл 0,55 н. раствора  (
(  1,078 г/мл)? Рассчитайте массу вещества и воды в приготовленном растворе.
1,078 г/мл)? Рассчитайте массу вещества и воды в приготовленном растворе.
3.25. Какой объем воды следует добавить к 60 мл раствора бромида аммония с массовой долей 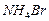 0,3 (
0,3 (  1,20 г/мл), чтобы получить раствор, молярная концентрация эквивалентов которого равна 1,55 (
1,20 г/мл), чтобы получить раствор, молярная концентрация эквивалентов которого равна 1,55 (  1,07 г/мл). Найдите массовую долю
1,07 г/мл). Найдите массовую долю 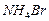 в приготовленном растворе.
в приготовленном растворе.
Задача 4
4.1. Какой объём 3,3 н. раствора сульфата никеля  (
(  1,19 г/мл) следует добавить к 200 мл 0,66 М раствора (
1,19 г/мл) следует добавить к 200 мл 0,66 М раствора (  1,08 г/мл), чтобы получить 12 %-й (по массе) раствор
1,08 г/мл), чтобы получить 12 %-й (по массе) раствор  (
(  1,12 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,12 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.2. Какой объём 0,51 М раствора (  1,02 г/мл) гидроксида натрия необходимо взять, чтобы при добавлении к нему 16,5 г твёрдого
1,02 г/мл) гидроксида натрия необходимо взять, чтобы при добавлении к нему 16,5 г твёрдого  массовая доля гидроксида натрия возросла до
массовая доля гидроксида натрия возросла до
11 %? Для полученного раствора (  1,12 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,12 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.3. К 1149 мл 2,87 М раствора соляной кислоты  (
(  1,047 г/мл) прилили 1047 мл 9,44 М раствора
1,047 г/мл) прилили 1047 мл 9,44 М раствора  (
( 
1,149 г/мл). Для полученного раствора (  1,1 г/мл) рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,1 г/мл) рассчитайте: массовую долю, молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.4. В лаборатории имеются: 60 %-й (по массе) раствор (  1,5 г/мл) и 30 %-й (по массе) раствор (
1,5 г/мл) и 30 %-й (по массе) раствор (  1,2 г/мл) серной кислоты
1,2 г/мл) серной кислоты  . Какой объём каждого раствора нужно взять, чтобы при их смешении получить 240 г раствора с массовой долей
. Какой объём каждого раствора нужно взять, чтобы при их смешении получить 240 г раствора с массовой долей  0,5 (
0,5 (  1,4 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,4 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.5. При охлаждении насыщенного при 100 °С раствора дихромата калия  до 20 °С выкристаллизовалось 100 г
до 20 °С выкристаллизовалось 100 г  , и получился раствор (
, и получился раствор (  1,068 г/мл) объёмом 264 мл, массовая доля
1,068 г/мл) объёмом 264 мл, массовая доля  в котором составляет 0,1. Определите растворимость
в котором составляет 0,1. Определите растворимость  при 100 °С (в граммах на 100 г воды). Рассчитайте для полученного после охлаждения раствора: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
при 100 °С (в граммах на 100 г воды). Рассчитайте для полученного после охлаждения раствора: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.6. Какой объём раствора бромида цинка (  1,2 г/мл), титр которого равен 0,24 г/мл, необходимо добавить к 400 мл 0,56 н. раствора
1,2 г/мл), титр которого равен 0,24 г/мл, необходимо добавить к 400 мл 0,56 н. раствора  (
(  1,05 г/мл), чтобы массовая доля бромида цинка в растворе стала равной 10 %? Для полученного раствора (
1,05 г/мл), чтобы массовая доля бромида цинка в растворе стала равной 10 %? Для полученного раствора (  1,10 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,10 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.7. Какой объём 0,5 н. раствора оксалата натрия  (
(  1,03 г/мл) необходимо взять, чтобы при добавлении к нему 7,07 г
1,03 г/мл) необходимо взять, чтобы при добавлении к нему 7,07 г  титр стал равным 0,108 г/мл? Для полученного раствора (
титр стал равным 0,108 г/мл? Для полученного раствора (  1,08 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, массовую долю
1,08 г/мл) рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, массовую долю  , титр.
, титр.
4.8. Смешали два раствора сульфата кадмия  : 500 мл 25 %-го (по массе) (
: 500 мл 25 %-го (по массе) (  1,289 г/мл) и 550 мл 40 %-го (по массе) (
1,289 г/мл) и 550 мл 40 %-го (по массе) (  1,574 г/мл). Для полученного раствора (
1,574 г/мл). Для полученного раствора (  1,430 г/мл) рассчитайте: массовую долю
1,430 г/мл) рассчитайте: массовую долю  , молярную концентрацию, моляльную концентрацию, титр.
, молярную концентрацию, моляльную концентрацию, титр.
4.9. В лаборатории имеются растворы красной кровяной соли, титр  в которых составляет 0,041 г/мл (
в которых составляет 0,041 г/мл (  1,02 г/мл) и 0,151 г/мл (
1,02 г/мл) и 0,151 г/мл (  1,08 г/мл). Какие объёмы растворов необходимо смешать, чтобы получился раствор объёмом 200 мл с массовой долей
1,08 г/мл). Какие объёмы растворов необходимо смешать, чтобы получился раствор объёмом 200 мл с массовой долей  0,1 и плотностью
0,1 и плотностью  1,05 г/мл? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,05 г/мл? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.10. При охлаждении 2,4 кг насыщенного при 45 °С раствора бромида калия  (
(  1,4 г/мл) выделилось 400 г твёрдого
1,4 г/мл) выделилось 400 г твёрдого  и получился раствор, в котором на 100 г воды приходится
и получился раствор, в котором на 100 г воды приходится
50 г  . Рассчитайте для исходного раствора: молярную концентрацию, молярную концентрацию эквивалентов, массовую долю
. Рассчитайте для исходного раствора: молярную концентрацию, молярную концентрацию эквивалентов, массовую долю  ,титр.
,титр.
4.11. Какой объём раствора вольфрамата натрия ( 
1,1 г/мл), титр  в котором равен 0,11 г/мл, необходимо взять, чтобы при добавлении к нему 30 г
в котором равен 0,11 г/мл, необходимо взять, чтобы при добавлении к нему 30 г  молярная концентрация стала равной 0,63 моль/л? Для полученного раствора (
молярная концентрация стала равной 0,63 моль/л? Для полученного раствора (  1,16 г/мл) рассчитайте: массовую долю
1,16 г/мл) рассчитайте: массовую долю  , молярную концентрацию эквивалентов, моляльную концентрацию, титр.
, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.12. В лаборатории имеются 0,84 н. (  1,08 г/мл) и 1,82 н. (
1,08 г/мл) и 1,82 н. (  1,16 г/мл) растворы ацетата бария
1,16 г/мл) растворы ацетата бария  . Какой объём каждого раствора нужно взять, чтобы после их смешения получить 250 мл 14 %-го (по массе) раствора
. Какой объём каждого раствора нужно взять, чтобы после их смешения получить 250 мл 14 %-го (по массе) раствора  (
(  1,1 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,1 г/мл)? Для полученного раствора рассчитайте: молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.13. К 577 мл 0,51 М раствора (  1,04 г/мл) перхлората натрия
1,04 г/мл) перхлората натрия  прилили 336 мл раствора (
прилили 336 мл раствора (  1,19 г/мл), титр
1,19 г/мл), титр  в котором равен 0,3094 г/мл. Для полученного раствора (
в котором равен 0,3094 г/мл. Для полученного раствора (  1,09 г/мл) рассчитайте: массовую долю
1,09 г/мл) рассчитайте: массовую долю  , молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
, молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.14. При упаривании 1,76 М раствора (  1,1 г/мл) хлорной кислоты
1,1 г/мл) хлорной кислоты  из него испарилось 3,35 моль воды и получился
из него испарилось 3,35 моль воды и получился
2 М раствор (  1,113 г/мл). Определите для исходного раствора: объём, молярную концентрацию эквивалентов, массовую долю
1,113 г/мл). Определите для исходного раствора: объём, молярную концентрацию эквивалентов, массовую долю  , моляльную концентрацию, титр.
, моляльную концентрацию, титр.
4.15. Какой объём 1,3 М раствора молибдата натрия  (
(  1,217 г/мл) нужно добавить к 150 мл 8 %-го (по массе) раствора
1,217 г/мл) нужно добавить к 150 мл 8 %-го (по массе) раствора  (
(  1,071 г/мл), чтобы получить раствор, титр
1,071 г/мл), чтобы получить раствор, титр  в котором равен 0,184 г/мл? Для полученного раствора (
в котором равен 0,184 г/мл? Для полученного раствора (  1,15 г/мл) рассчитайте: массовую долю
1,15 г/мл) рассчитайте: массовую долю  , молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию.
, молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию.
4.16. Какой объём 1 %-го (по массе) раствора силиката натрия  (
(  1,007 г/мл) необходимо взять, чтобы при добавлении к нему 1,7 г
1,007 г/мл) необходимо взять, чтобы при добавлении к нему 1,7 г  получился раствор, моляльность которого равна 0,167 моль/кг
получился раствор, моляльность которого равна 0,167 моль/кг  ? Для полученного раствора (
? Для полученного раствора (  1,015 г/мл) рассчитайте: массовую долю
1,015 г/мл) рассчитайте: массовую долю  , молярную концентрацию, молярную концентрацию эквивалентов, титр.
, молярную концентрацию, молярную концентрацию эквивалентов, титр.
4.17. В лаборатории имеются 20 %-й (по массе) (  1,16 г/мл) и 12 %-й (по массе) (
1,16 г/мл) и 12 %-й (по массе) (  1,1 г/мл) растворы нитрата кальция
1,1 г/мл) растворы нитрата кальция  . Какие объёмы растворов необходимо взять, чтобы после их смешивания получить 100 мл 2,2 н. раствора
. Какие объёмы растворов необходимо взять, чтобы после их смешивания получить 100 мл 2,2 н. раствора  ? Для полученного раствора (
? Для полученного раствора (  1,13 г/мл) рассчитайте: массовую долю
1,13 г/мл) рассчитайте: массовую долю  , молярную концентрацию, моляльную концентрацию, титр.
, молярную концентрацию, моляльную концентрацию, титр.
4.18. При упаривании 8 %-го (по массе) раствора ( 
1,067 г/мл) хлорида железа (III) испарилось 53,5 г воды и получился 2 н. раствор (  1,085 г/мл). Определите объём исходного раствора. Для раствора, полученного после упаривания, рассчитайте: массовую долю
1,085 г/мл). Определите объём исходного раствора. Для раствора, полученного после упаривания, рассчитайте: массовую долю  , молярную концентрацию, моляльную концентрацию, титр.
, молярную концентрацию, моляльную концентрацию, титр.
4.19. К 195 мл 4 %-го (по массе) раствора хлорида натрия (  1,026 г/мл) прибавили 428 мл 1,83 М раствора (
1,026 г/мл) прибавили 428 мл 1,83 М раствора ( 
1,070 г/мл). Для полученного раствора (  1,056 г/мл), рассчитайте: массовую долю
1,056 г/мл), рассчитайте: массовую долю  ,молярную концентрацию, молярную концентрацию эквивалентов.
,молярную концентрацию, молярную концентрацию эквивалентов.
4.20. Какой объём 20 %-го (по массе) раствора гидроксида калия  (
(  1,176 г/мл) необходимо добавить к 100 мл 50 %-го (по массе) раствора (
1,176 г/мл) необходимо добавить к 100 мл 50 %-го (по массе) раствора (  1,525 г/мл)
1,525 г/мл)  , чтобы получить раствор с массовой долей гидроксида калия 0,25 (
, чтобы получить раствор с массовой долей гидроксида калия 0,25 (  1,229 г/мл). Для полученного раствора рассчитайте: моляльную концентрацию, молярную концентрацию, молярную концентрацию эквивалентов, титр.
1,229 г/мл). Для полученного раствора рассчитайте: моляльную концентрацию, молярную концентрацию, молярную концентрацию эквивалентов, титр.
4.21. При охлаждении насыщенного при 80 °С раствора (  1,30 г/мл) нитрата аммония
1,30 г/мл) нитрата аммония  выделилось 1,5 моль нитрата аммония и получился раствор (
выделилось 1,5 моль нитрата аммония и получился раствор (  1,34 г/мл) объёмом
1,34 г/мл) объёмом
70 мл, в котором на 100 г воды приходится 192 г  . Определите растворимость нитрата аммония в воде при 80 °С (в массовых долях). Для полученного, после охлаждения, раствора рассчитайте: массовую долю
. Определите растворимость нитрата аммония в воде при 80 °С (в массовых долях). Для полученного, после охлаждения, раствора рассчитайте: массовую долю  , молярную концентрацию, титр, моляльную концентрацию.
, молярную концентрацию, титр, моляльную концентрацию.
4.22. Смешали 100 мл 2,6 н. раствора (  1,04 г/мл) и 80 мл 30 %-го раствора (
1,04 г/мл) и 80 мл 30 %-го раствора (  1,1 г/мл) карбоната аммония
1,1 г/мл) карбоната аммония  . Для полученного раствора (
. Для полученного раствора (  1,07 г/мл) рассчитайте: массовую долю
1,07 г/мл) рассчитайте: массовую долю  , молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
, молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.23. Какой объём 6 %-го (по массе) раствора (  1,015 г/мл) нитрата серебра
1,015 г/мл) нитрата серебра  необходимо взять, чтобы при добавлению к нему 1,9 г
необходимо взять, чтобы при добавлению к нему 1,9 г  молярная концентрация стала бы равной 0,37 моль/л? Для полученного раствора (
молярная концентрация стала бы равной 0,37 моль/л? Для полученного раствора (  1,05 г/мл) рассчитайте: массовую долю AgNO3, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
1,05 г/мл) рассчитайте: массовую долю AgNO3, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.24. Какой объём 30%-го (по массе) раствора соляной кислоты  (
(  1,149 г/мл) нужно добавить к 5 л 0,5 М раствора
1,149 г/мл) нужно добавить к 5 л 0,5 М раствора  (
(  1,007 г/мл), чтобы получить одномолярный раствор соляной кислоты? Для полученного раствора (
1,007 г/мл), чтобы получить одномолярный раствор соляной кислоты? Для полученного раствора (  1,016 г/мл) рассчитайте: массовую долю
1,016 г/мл) рассчитайте: массовую долю  , молярную концентрацию эквивалентов, моляльную концентрацию, титр.
, молярную концентрацию эквивалентов, моляльную концентрацию, титр.
4.25. В лаборатории имеются 1,2 М (  1,01 г/мл) и 9,8 М (
1,01 г/мл) и 9,8 М (  1,11 г/мл) растворы пероксида водорода
1,11 г/мл) растворы пероксида водорода  . Какие объёмы растворов необходимо взять, чтобы при их смешении получилось 250 г раствора, титр которого равен 0,104 г/мл? Для полученного раствора (
. Какие объёмы растворов необходимо взять, чтобы при их смешении получилось 250 г раствора, титр которого равен 0,104 г/мл? Для полученного раствора (  1,04 г/мл) рассчитайте: массовую долю
1,04 г/мл) рассчитайте: массовую долю  , молярную концентрацию, моляльную концентрацию, мольную долю H2O2.
, молярную концентрацию, моляльную концентрацию, мольную долю H2O2.
Задача 5
5.1. Оксид серы (VI)  массой 5,4 г растворили в 50 мл воды и получили раствор с плотностью
массой 5,4 г растворили в 50 мл воды и получили раствор с плотностью  1,08 г/мл. Определите массовую долю и нормальную концентрацию кислоты в полученном растворе.
1,08 г/мл. Определите массовую долю и нормальную концентрацию кислоты в полученном растворе.
5.2. Сколько граммов арсената серебра образуется при сливании 2 л 0,303 М раствора нитрата серебра  и 1,5 л
и 1,5 л
0,212 М раствора арсената натрия  ?
?
5.3. Какой объём 0,5 н раствора серной кислоты  необходим для нейтрализации 20 мл 11 %-го (по массе) раствора гидроксида калия
необходим для нейтрализации 20 мл 11 %-го (по массе) раствора гидроксида калия  (
(  1,1 г/мл)?
1,1 г/мл)?
5.4. Какую массу оксалата кальция  можно растворить в 200 мл двухмоляльного раствора соляной кислоты
можно растворить в 200 мл двухмоляльного раствора соляной кислоты  (
(  1,03 г/мл)?
1,03 г/мл)?
5.5. Какой объём 24 %-го (по массе) раствора гидроксида натрия  (
(  1,26 г/мл) потребуется для осаждения гидроксида железа (III) из 100 мл 0,2 М раствора хлорида железа (III)
1,26 г/мл) потребуется для осаждения гидроксида железа (III) из 100 мл 0,2 М раствора хлорида железа (III) 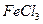 ?
?
5.6. Осадок сульфида кобальта (II)  массой 8,2 г растворили, добавив 180 мл раствора серной кислоты. Определите массовую долю и молярную концентрацию
массой 8,2 г растворили, добавив 180 мл раствора серной кислоты. Определите массовую долю и молярную концентрацию  в использованном растворе (
в использованном растворе (  1,03 г/мл).
1,03 г/мл).
5.7. При растворении гидрида кальция  в 500 мл воды выделилось 224 мл водорода (условия нормальные). Определите массовую долю гидроксида кальция в полученном растворе.
в 500 мл воды выделилось 224 мл водорода (условия нормальные). Определите массовую долю гидроксида кальция в полученном растворе.
5.8. Сколько граммов хромата бария можно получить из
150 мл раствора нитрата бария  , титр которого равен 0,063 г/мл, при взаимодействии с избытком хромата аммония
, титр которого равен 0,063 г/мл, при взаимодействии с избытком хромата аммония  ?
?
5.9. На нейтрализацию 25 мл раствора уксусной кислоты  (
(  1,0 г/мл) израсходовано 15 мл 1 М раствора гидроксида натрия
1,0 г/мл) израсходовано 15 мл 1 М раствора гидроксида натрия  . Определите массовую долю и моляльную концентрацию
. Определите массовую долю и моляльную концентрацию  в растворе.
в растворе.
5.10. Какой объём 7 %-го (по массе) раствора гидроксида калия (  1,06 г/мл) необходим для растворения 39 г гидроксида алюминия
1,06 г/мл) необходим для растворения 39 г гидроксида алюминия  ?
?
5.11. Сколько граммов оксида натрия  нужно растворить в 100 мл воды, чтобы получить 11 %-й (по массе) раствор гидроксида натрия?
нужно растворить в 100 мл воды, чтобы получить 11 %-й (по массе) раствор гидроксида натрия?
5.12. Из 110 мл раствора хромата натрия  (
( 
1,15 г/мл) при взаимодействии с раствором нитрата серебра  осадили 41,5 г хромата серебра. Определите массовую долю
осадили 41,5 г хромата серебра. Определите массовую долю  в исходном растворе.
в исходном растворе.
5.13. К 10 мл 2 М раствора гидроксида натрия  (
( 
1,1 г/мл) прилили 5 мл 1 М раствора ортофосфорной кислоты  (
(  1,05 г/мл). Определите массовую долю полученной соли в растворе.
1,05 г/мл). Определите массовую долю полученной соли в растворе.
5.14. Какую массу лития нужно взять, чтобы при его растворении в 200 мл воды получить 5 %-й (по массе) раствор гидроксида лития?
5.15. Какую массу карбоната магния можно осадить при взаимодействии 300 мл 0,5 М раствора карбоната натрия  и 112 мл 10 %-го (по массе) раствора хлорида магния
и 112 мл 10 %-го (по массе) раствора хлорида магния  (
(  1,1 г/мл)?
1,1 г/мл)?
5.16. Какой объём 2,5 н. раствора азотной кислоты  необходимо взять для растворения 64,7 г мрамора, массовая доля карбоната кальция
необходимо взять для растворения 64,7 г мрамора, массовая доля карбоната кальция  в котором составляет 85 %?
в котором составляет 85 %?
5.17. Сколько граммов малорастворимого иодата лантана образуется при сливании 20 мл 0,1 н. раствора иодата натрия  и 12 мл 0,06 н. раствора нитрата лантана
и 12 мл 0,06 н. раствора нитрата лантана  ?
?
5.18. Какой объём 0,074 М раствора гидроксида бария  необходим для реакции с 10 мл 24 %-го (по массе) раствора соляной кислоты
необходим для реакции с 10 мл 24 %-го (по массе) раствора соляной кислоты  (
(  1,12 г/мл)?
1,12 г/мл)?
5.19. Какую массу оксида марганца (II)  можно растворить в 100 мл 1,5 М раствора серной кислоты (
можно растворить в 100 мл 1,5 М раствора серной кислоты (  1,1 г/мл). Определите массовую долю полученной соли в растворе.
1,1 г/мл). Определите массовую долю полученной соли в растворе.
5.20. Какая масса кристаллогидрата  потребуется для количественного осаждения сульфат-ионов из 2 л 0,16 М раствора серной кислоты?
потребуется для количественного осаждения сульфат-ионов из 2 л 0,16 М раствора серной кислоты?
5.21. Какую массу гидроксида цинка  можно растворить в 50 мл 20 %-го раствора гидроксида натрия (
можно растворить в 50 мл 20 %-го раствора гидроксида натрия (  1,22 г/мл)?
1,22 г/мл)?
5.22. Какой объём раствора нитрата серебра  потребуется для реакции с 23 мл 0,584 н. раствора хлорида бария
потребуется для реакции с 23 мл 0,584 н. раствора хлорида бария  ? Какова масса полученного осадка?
? Какова масса полученного осадка?
5.23. Какой объём двухмоляльного раствора хлорида кальция  (
(  1,1.6 г/мл) потребуется для осаждения 23,2 г силиката кальция из раствора силиката калия
1,1.6 г/мл) потребуется для осаждения 23,2 г силиката кальция из раствора силиката калия  ?
?
5.24. Сколько граммов гидроксида кальция  необходимо для реакции с 1,2 мл 70 %-го (по массе) раствора хлорной кислоты
необходимо для реакции с 1,2 мл 70 %-го (по массе) раствора хлорной кислоты  (
(  1,6 г/мл)?
1,6 г/мл)?
5.25. Какую массу цинка можно растворить в 125 мл 10 %-го (по массе) раствора соляной кислоты  (
(  1,05 г/мл)? Какой объём газа при этом выделится? Условия нормальные.
1,05 г/мл)? Какой объём газа при этом выделится? Условия нормальные.