 |
|
Составление ионно-молекулярных уравнений
Реакции в водных растворах электролитов являются реакциями между ионами. Они протекают, в соответствии с правилом Бертолле, практически необратимо в тех случаях, когда в результате их взаимодействия образуются малорастворимые вещества (осадки или газы) или малодиссоциированные соединения (слабые электролиты, комплексные ионы, вода). В уравнениях реакций малорастворимые вещества, выпадающие в осадок, отмечаются стрелкой, направленной вниз, газообразные вещества стрелкой, направленной вверх. Например:

Для составления ионно-молекулярного уравнения необходимо последовательно выполнить следующие действия:
1) написать молекулярное уравнение реакции;
2) записать в виде ионов формулы сильных кислот, сильных оснований, хорошо растворимых солей (см. таблицу растворимости в Приложении 4); формулы остальных веществ записать в виде молекул; полученное уравнение называют полным ионно-молекулярным уравнением;
3) исключить из обеих частей полного ионно-молекулярного уравнения одинаковые ионы;
4) записать сокращенное ионно-молекулярное уравнение в окончательном виде.
Пример 26. Составьте молекулярное и ионно-молекулярное уравнение реакции взаимодействия в растворе между  и
и  .
.
Решение.Составляем уравнение реакции взаимодействия веществ в молекулярном виде:
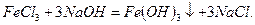
По таблице растворимости устанавливаем, что  и
и 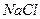 - растворимые в воде соли,
- растворимые в воде соли,  - осадок, а
- осадок, а  - сильный электролит. Составим полное ионно-молекулярное уравнение, записав растворимые соли и сильные основания в виде ионов, а осадок
- сильный электролит. Составим полное ионно-молекулярное уравнение, записав растворимые соли и сильные основания в виде ионов, а осадок  в виде молекулы:
в виде молекулы:

Исключаем из обеих частей полного ионно-молекулярного уравнения одинаковые ионы:

Записываем сокращенное ионно-молекулярное уравнение реакции:

Это ионно-молекулярное уравнение выражает сущность проходящей химической реакции.