 |
|
КОНТРОЛЬНЫЕ Задания для самостоятельноЙ РАБОТЫ
Задача 16
Вычислить  следующих растворов электролитов:
следующих растворов электролитов:
| N варианта | Электролит | Концентрация раствора | Константа диссоциации Кд | Степень диссоциации α | |
| HCI | 0,001 M | - | |||
| Zn(OH)2 | 0,1M | 4,4 ∙ 10-5 | - | ||
| NaOH | 0,05 н. | - | |||
| HNО2 | 0,15 н. | 4,6 ∙ 10-4 | - | ||
| HNО3 | 0,063 г/л | - | |||
| NH4OH | 1 н. | 1,8 ∙ 10-5 | - | ||
| КОН | 0,0056 г/л | - | |||
| HF | 1 н. | - | 0,07 | ||
| НВг | 0,0001 н. | - | |||
| H2S | 0,1 М | 1,1 ∙ 10-7 | - | ||
| RbOH | 0,03 н. | - | |||
| H2S | 0,1 М | - | 0,0007 | ||
| h2so4 | 0,0001 н. | - | |||
| HNО2 | 0,025 н. | 4,6 ∙ 10-4 | - | ||
| CsOH | 0,15 г/л | ||||
| НВrO | 0,2 М | 2,1 ∙ 10-9 | - | ||
| НClO4 | 0,001 н. | - | |||
| nh4OH | 0,03 М | 1,8 ∙ 10-5 | - | ||
| HNО3 | 0,0001 н. | - | |||
| hcn | 1М | 7,9 ∙ 10-2 | - | ||
| NaOH | 0,0001 н. | - | |||
| Н2СО3 | 0,1 М | - | 0,0017 | ||
| H2SО4 | 0,0098 г/л | - | |||
| CH3COOH | 0,0001 н. | - | 0,306 | ||
| КОН | 0,1 % | - | |||
| НСООН | 0,2 М | 1,8 ∙ 10-4 | - | ||
| HCI | 0,01 % | - | |||
| CH3COOH | 0,1 н. | - | 0,004 | ||
| NaOH | 0,0004 г/л | - | |||
| Н2СО3 | 0,1 М | 4,5 ∙ 10-7 | - | ||
| HNО3 | 0,01 % | - | |||
| NH4OH | 0,02 н. | 1,8 ∙ 10-5 | - | ||
| КОН | 0,0001 н. | - | |||
| HF | 0,1 н. | 6,6 ∙ 10-4 | - | ||
| НВг | 1 г/л | - | |||
| СН3СООН | 0,001 н. | 0,118 | |||
| RbOH | 0,0001 н. | - | |||
| НСООН | 0,1 М | 1,8 ∙ 10-4 | - | ||
| H2SO4 | 0,0196 г/л | - | |||
| HNO2 | 0,01М | 4,6 ∙ 10-4 | - | ||
| Ca(OH)2 | 0,1 г/л | - | |||
| H2SiO3 | 0,1 М | 2,2 ∙ 10-10 | - | ||
| HCIO4 | 0,0005 н. | - | |||
| Н2СОэ | 0,006 М | - | 0,85 | ||
| HNO3 | 0,05 % | - | |||
| НВrO | 0,001 н. | 2,1 ∙ 10-9 | - | ||
| NaOH | 0,001 н. | - | |||
| HClO | 0,005 н. | 5 ∙ 10-8 | - | ||
| H2SO4 | 0,0005 н. | - | |||
| NH4OH | 0,5 н. | 1,8 ∙ 10-5 | - | ||
Задача 17
Вычислить концентрацию ионов  и
и  в растворе, а также концентрацию электролита,
в растворе, а также концентрацию электролита,  которого равен … .
которого равен … .
| Вариант | 
| Электролит | Вариант | 
| Электролит |
| H2SO4 | 2,6 | HNО3 | |||
| 2,5 | HCI | 5,2 | HBr | ||
| H2SO4 | Ва(ОН)2 | ||||
| Ca(OH)2 | 5,4 | HCI | |||
| 3,5 | HNО3 | 3,6 | HNО3 | ||
| 5,5 | HCI | 2,8 | НClO4 | ||
| 6,3 | HNО3 | H2SO4 | |||
| Ва(ОН)2 | 4,1 | HCI | |||
| H2SO4 | 5,3 | HNO3 | |||
| 4,5 | НClO4 | H2SO4 | |||
| Ca(OH)2 | 3,7 | HBr | |||
| 3,2 | НВг | Ca(OH)2 | |||
| 2,8 | HNО3 | 2,5 | HNО3 |
Задача 18
Вычислить  раствора, если к
раствора, если к 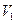 (. . .) мл раствора
(. . .) мл раствора  прибавлено
прибавлено 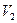 (. . .) мл воды. Плотности растворов принять равными 1 г/мл.
(. . .) мл воды. Плотности растворов принять равными 1 г/мл.
| № варианта | Раствор А | Объем воды V2,мл | № варианта | Раствор А | Объем воды V2, мл | ||||
| объем V1, мл | концентрация | растворенное вещество | объем V1, мл | концентрация | растворенное вещество | ||||
| 50,0 | 0,01 н. | H2SO4 | 10,0 | 0,05 н. | H2SO4 | ||||
| 30,0 | 0,05 М | NaOH | 20,0 | 0.01 н. | NaOH | ||||
| 15,0 | 0,08 н. | HCI | 2,0 | 0,003 н. | HCI | ||||
| 60,0 | 0,1 н. | КОН | 2,0 | 0,002М | КОН | ||||
| 25,0 | 0,4 н. | HNO3 | 1,0 | 0,5 М | HN03 | ||||
| 40,0 | 0,05 н. | Ва(ОН)2 | 25,0 | 0,01 н. | Ва(ОН)2 | ||||
| 20,0 | 0,002М | HCIО4 | 1,0 | 0,005М | HCIO4 | ||||
| 10,0 | 0,005М | Са(ОН)2 | 15,0 | 0,001 н. | Са(ОН)2 | ||||
| 50,0 | 0,06 н. | Н3РО4 | 50,0 | 0,001 н. | Н3Р04 | ||||
| 10,0 | 0,05 н. | LiOH | 20,0 | 0,1 н. | LiOH | ||||
| 35,0 | 0,01 М | НВr | 1.0 | 0,003 н. | НВг | ||||
| 20,0 | 0,02 н. | NaOH | 10,0 | 0,08 М | NaOH | ||||
| 30,0 | 0,01 М | H2SО4 | 1,0 | 0,005 н. | H2S04 |
Задача 19
Определить  раствора, полученного при сливании растворов
раствора, полученного при сливании растворов  и
и 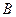 .
.
| № | Раствор А | Раствор В | ||||
| объем, мл | концентрация | раство-ренное вещество | объем, мл | концентрация | раство-ренное вещество | |
| 0,2 н. | HCl | 0,1 н. | NaOH | |||
| 0,05 М | HClO4 | 0,03 н. | KOH | |||
| 0,25 М | HCl | 0,05 н. | NaOH | |||
| 0,6 н. | HNO3 | 0,4 н. | KOH | |||
| 0,02 М | HCl | 0,006 М | NaOH | |||
| 0,1 н. | HNO3 | 6 % ρ=1,07 г/мл | NaOH | |||
| 0,06 М | Ba(OH)2 | 0,08 н. | H2SO4 | |||
| 0,075 н. | HClO4 | 0,055 н. | KOH | |||
| 0,1 н. | H2SO4 | 0,1 н. | NaOH | |||
| 0,2 н. | HCl | 3 % ρ=1,03 г/мл | KOH | |||
| 0,02 н. | HBr | 0,04 М | NaOH | |||
| 0,2 М | HNO3 | 0,2 н. | Ca(OH)2 | |||
| 0,2 М | H2SO4 | 0,6 н. | CsOH | |||
| 0,004 М | HNO3 | 0,001 н. | Ca(OH)2 | |||
| 6 М | HBr | 2 н. | NaOH | |||
| 0,03 М | HNO3 | 0,05 М | KOH | |||
| 1,0 М | HCl | 0,095 н. | NaOH | |||
| 0,1 н. | HNO3 | 0,1 н. | NaOH | |||
| 0,1 н. | HCl | 0,2 н. | Ca(OH)2 | |||
| 0,1 н. | H2SO4 | 0,1 н. | NaOH | |||
| 0,15 н. | HCl | 0,075 н. | KOH | |||
| 0,05 н. | HNO3 | 0,02 н. | Ba(OH)2 | |||
| 0,4 н. | HClO4 | 0,4 н. | KOH | |||
| 0,2 н. | HBr | 0,3 н. | NaOH | |||
| 0,1 н. | HCl | 6% ρ=1,07 г/мл | NaOH |
Гидролиз солей
Гидролиз - реакция ионного обмена между различными веществами и водой. Процессу гидролиза подвергаются соли, углеводы, белки, эфиры, жиры и т.д.
Гидролиз соли - это взаимодействие между ионами соли и ионами воды, приводящее к образованию слабого электролита.
Гидролиз солей обусловлен взаимной электролитической диссоциацией солей и воды, а также образующихся в результате гидролиза кислот, оснований и солей. Гидролиз протекает с образованием малодиссоциированных, летучих или малорастворимых веществ. В процессе гидролиза один или оба иона незначительно диссоциирующей воды связываются ионами подвергающейся гидролизу соли, вследствие чего все новые и новые молекулы воды вовлекаются в реакцию. Гидролизу подвергаются соли, образованные:
- слабым основанием и сильной кислотой (например,  ,
,  );
);
- сильным основанием и слабой кислотой (например,  ,
,  );
);
- слабым основанием и слабой кислотой (например, 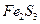 ;
;  ).
).
Рассмотрим три случая гидролиза:
1. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону.
Например, соль  образована слабым основанием
образована слабым основанием 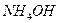 и сильной кислотой
и сильной кислотой 
 .
.
В водном растворе соль диссоциирует на катионы 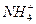 и анионы
и анионы 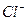 :
:
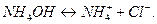
Гидролиз идет по иону слабого электролита, то есть по катиону 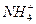 :
:
 .
.
Это сокращенное молекулярно-ионное уравнение данного процесса. Для составления молекулярного уравнения катионы 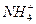 и высвобождающийся ион водорода нужно объединить с анионом сильной кислоты (
и высвобождающийся ион водорода нужно объединить с анионом сильной кислоты ( 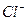 ):
):
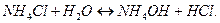
Накопление ионов  приводит к тому, что реакция среды становится кислой,
приводит к тому, что реакция среды становится кислой, 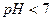 .
.
Если соль образована сильной кислотой и слабым многокислотным основанием, гидролиз протекает ступенчато. Например,соль  образована слабым двухкислотным основанием
образована слабым двухкислотным основанием  и сильной кислотой
и сильной кислотой  В водном растворе эта соль диссоциирует:
В водном растворе эта соль диссоциирует:

Возможны две ступени гидролиза:
1 ступень: 
Для составления молекулярного уравнения, образовавшиеся положительно заряженные ионы (  ) нужно объединить с анионами сильной кислоты (
) нужно объединить с анионами сильной кислоты (  ) и составить формулы соединений с учетом зарядов ионов:
) и составить формулы соединений с учетом зарядов ионов:
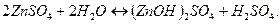
2 ступень: 

Практически (преимущественно) гидролиз идет только по первой ступени.
2. Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону. Например,соль  образована сильным основанием
образована сильным основанием  и слабой кислотой
и слабой кислотой  . Ее диссоциация:
. Ее диссоциация:

Гидролиз идет по аниону:

Для составления молекулярного уравнения высвобождающийся гидроксид ион (  ) и ион
) и ион  нужно объединить с катионом сильного основания (
нужно объединить с катионом сильного основания ( 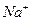 ):
):
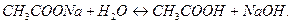
Накапливание ионов  создает щелочную реакцию среды (
создает щелочную реакцию среды ( 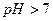 ).
).
Гидролиз солей слабых многоосновных кислот протекает ступенчато. Например, соль 
 образована сильным основанием
образована сильным основанием  и слабой двухосновной кислотой
и слабой двухосновной кислотой 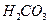 . Ее диссоциация:
. Ее диссоциация:

Возможны две ступени гидролиза:
1 ступень: 
Чтобы составить молекулярное уравнение нужно все отрицательно заряженные ионы объединить с катионами сильного основания ( 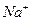 ) и составить формулы соединений:
) и составить формулы соединений:

2 ступень: 

Практически (преимущественно) гидролиз идет только по первой ступени
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону, и по аниону. Например,соль  образована слабым основанием
образована слабым основанием 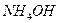 и слабой кислотой
и слабой кислотой  . Ее диссоциация:
. Ее диссоциация:
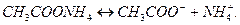
Гидролизуя катион и анион, получим:

Суммируя процессы гидролиза по катиону и по аниону и учитывая, что 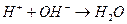 , получим суммарное уравнение гидролиза по катиону и по аниону:
, получим суммарное уравнение гидролиза по катиону и по аниону:
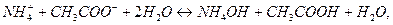 или
или

Реакция среды в этом случае близка к нейтральной, так как не происходит заметного накопления избытка ионов  или
или  (
( 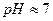 ).
).
Если кислота и основание, образующие соль, не только слабые электролиты, но и малорастворимы или неустойчивы, то гидролиз сопровождается полным разложением соли:
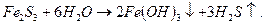
Полному гидролизу в водных растворах подвергаются также нитриды, фосфиды, карбиды и силициды металлов:

Соли, образованные сильным основанием и сильной кислотой, например, 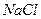 , гидролизу не подвергаются, среда остается нейтральной (
, гидролизу не подвергаются, среда остается нейтральной (  ).
).