 |
|
Растворенного вещества в растворе
РАСТВОРЫ
Основные понятия
Растворомназывают гомогенную систему, состоящую из двух или более компонентов.
Один из компонентов раствора – растворитель, остальные – растворенные вещества. Растворителем обычно считают тот компонент, чье агрегатное состояние не изменяется при образовании раствора. Если оба компонента находятся в одинаковом агрегатном состоянии, то растворителем является тот компонент, который находится в большем количестве.
Растворы бывают насыщенными, ненасыщенными и пересыщенными.
Насыщенный раствор – это раствор, который находится в равновесии с твердой фазой растворенного вещества, т.е. содержит максимально возможное количество растворенного вещества при данной температуре.
Ненасыщенный раствор – это раствор, концентрация которого меньше концентрации насыщенного раствора.
Пересыщенный раствор – это раствор, в котором растворяемого вещества содержится больше, чем в насыщенном при данной температуре.
Растворимостью называют способность одного вещества растворятся в другом. Количественно растворимость твердых веществ и жидкостей определяется коэффициентом растворимости. Коэффициент растворимости выражается массой вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора. Обычно вещество считают растворимым (р), если величина коэффициента растворимости превышает 1. При коэффициенте растворимости от 1 до 0,01 вещество мало растворимо (м). При коэффициенте растворимости менее 0,01 вещество практически нерастворимо (н).
Растворение веществ часто сопровождается выделением или поглощением теплоты. Что является следствием химического взаимодействия растворенного вещества с растворителем. Этот процесс называется гидратацией, если растворитель – вода, или сольватацией, если взят неводный растворитель. При этом образуются соединения, который соответственно называются гидратами и сольватами.
Гидраты, как правило, не стойкие вещества. Но некоторые из них настолько прочны, что вода входит в состав кристаллов растворенного вещества. Такие вещества называются кристаллогидратами,а содержащаяся в них вода называется кристаллизационной.
Состав кристаллогидрата изображается формулой, которая показывает какое количество кристаллизационной воды содержится в кристаллогидрате:
· медный купорос (кристаллогидрат сульфата меди) – CuSO4·5H2O;
· глауберова соль (кристаллогидрат сульфата натрия) – Na2SO4·10H2O.
Способы выражения содержания
растворенного вещества в растворе
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями. Наиболее часто употребляемыми в химии способами выражения содержания растворенного вещества в растворе являются: массовая и мольная доли, молярная, эквивалентная и моляльная концентрации, а также титр раствора.
1) Массовая доля – это соотношение массы растворенноговещества к массе раствора, выраженное в долях или процентах, показывает число граммов растворенного вещества в 100 г раствора.
 ,
,
где mр.в - масса растворенного вещества, г;
m р-ра – масса раствора,г;
m р-ра = m р-ля + mр.в ,
где m р-ля - масса растворителя, г.
2) Мольная доля - это отношение числа молей растворенного вещества (или растворителя) к сумме числа молей растворенного вещества и растворителя.
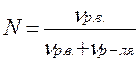 ,
,
где νр.в. - число молей растворенного вещества, моль;
νр-ля. - число молей растворителя, моль.
3) Молярная концентрация (молярность) – это отношение количества растворенного вещества к объему раствора, показывает число молей растворенного вещества в 1 литре раствора.
 ; моль/л
; моль/л
где М - молярная масса растворенного вещества, г/моль;
VР-РА – объем раствора, л;
4) Эквивалентная или нормальная концентрация (нормальность) – отношение числа эквивалентов растворенного вещества к объему раствора, показывает число эквивалентов растворенного вещества в 1 литре раствора.
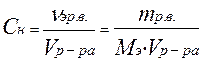 ; моль/л
; моль/л
где МЭ - эквивалентная масса растворенного вещества, г/моль;
νэр.в. - число эквивалентов растворенного вещества, моль;
5) Моляльная концентрация (моляльность) – это отношение количества растворенного вещества к массе растворителя, показывает сколько молей растворенного вещества содержится в 1 кг растворителя.
 ; моль/кг
; моль/кг
6) Титр – это масса растворенного вещества, приходящаяся на 1 мл раствора.

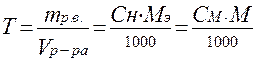 ; г/мл
; г/мл