 |
|
Электролиты, которые в разбавленном водном растворе диссоциируют частично, называют слабыми. Диссоциация слабых электролитов - обратимый процесс
например:
| a (при 25° С) | |
| HCN « H+ + CN- | 7·10-5 (или 0,007%) |

| 0,013 (или 1,3%) |
Степень электролитической диссоциации зависит от:
- природы электролита и растворителя;
- концентрации раствора;
- температуры
и возрастает при увеличении разбавления раствора:
| C(CH3COOH) , моль/л | 0,2 | 0,1 | 0,05 | 0,01 | 0,005 | 0,001 |
| a , % (при 25° С) | 0,05 | 1,4 | 1,9 | 4,2 | 6,0 | 12,4 |
| слабый электролит | электролит средней силы |
Степень диссоциации возрастает при увеличении температуры раствора. Увеличение кинетической энергии растворенных частиц способствует распаду молекул на ионы, что приводит к возрастанию степени диссоциации при нагревании растворов.
Если в растворе слабой кислоты или слабого основания увеличить концентрацию одноименного иона введением соответствующей соли, то наблюдается резкое изменение степени диссоциации слабого электролита. Рассмотрим, например, как изменится a уксусной кислоты (CH3COOH) при введении в раствор ацетата натрия (введение одноименных ионов CH3COO-).
Согласно принципу Ле Шателье равновесие процесса диссоциации
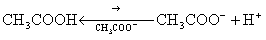
сместится влево в результате увеличения концентрации ацетат-ионов CH3COO-, образующихся при диссоциации ацетата натрия:
CH3COONa ® CH3COO- + Na+.
Такое смещение равновесия в сторону образования CH3COOH означает уменьшение степени ее диссоциации и приводит к уменьшению концентрации ионов водорода, например:
| C(CH3COOH), моль/л | 0,01 | 0,01 |
| C(CH3COONa), моль/л | 0,01 | |
| [H+], моль/л | 4,32·0-4 | 1,86·10-5 |
Таким образом, в результате введения в 1 л 0,01 М раствора CH3COOH 0,01 моль CH3COONa концентрация ионов водорода уменьшилась в
 .
.
С точки зрения теории электролитической диссоциации амфотерные гидроксиды (амфолиты) - это вещества, диссоциирующие в водном растворе как по типу кислот, так и по типу оснований. К ним относят Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3, и др. Например, уравнения электролитической диссоциации Be(OH)2:
1) диссоциация по типу основания:
Be(OH)2 + 3H2O « OH- + [BeOH(H2O)3]
[BeOH(H2O)3] + H2O « OH- + [Be(H2O)4]
2) диссоциация по типу кислоты:
Be(OH)2 + 2H2O « H+ + [Be(OH)3H2O]
[Be(OH)2H2O] « H+ + [Be(OH)3]
7.6.1.3.  Закон разведения Оствальда
Закон разведения Оствальда
Между константой и степенью диссоциации существует определенная закономерность, которую в 1888 г. обнаружил В.Оствальд и сумел ее объяснить. Эта закономерность впоследствии была названа законом разведения Оствальда.
Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Kд связана с a простой зависимостью. Если общую молярную концентрацию электролита в растворе обозначить СКА , то для бинарных электролитов концентрации ионов Ky+ и Ax- будут равны a·CKA . Очевидно, что
[Ky+] = [Ax-] = a·CKA ,
[KA] = CKA - a·CKA = CKA·(1-a ), тогда
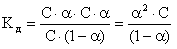 (7.6.6.)
(7.6.6.)
Для слабых электролитов a ® 0 и (1 - a ) ® 1. Следовательно,
 (7.6.7.)
(7.6.7.)
Полученная зависимость является математическим выражением закона разбавления Оствальда:
степень диссоциации слабого электролита увеличивается при разбавлении раствора обратно пропорционально корню квадратному из его молярной концентрации.