 |
|
Влияние температуры
Закон Генри
Количество газа,растворённого в единице объёме раствораназываетсярастворимостью: м3 /м3, г/л, моль/л и т. д.
Растворимость газа в жидкостиопределяет способность чистого газового компонента или смеси газов образовывать с жидкостью гомогенные растворы.
Растворимость газа увеличивается с ростом давления:
Р, мм рт. ст. 102 390 874 1160
g, г/л 2.74 10,6 24,0 31,6
Газ в силу большой летучести не может растворятся в жидкости бесконечно и уже при небольшой концентрации устанавливается равновесие "раствор-газ",при этом не просто раствор, а насыщенный раствор при данных р и Т.
Процесс растворения идеального газа при сравнительно невысоких давлениях, в отсутствие химического взаимодействия газа с жидкостью, описывается законом Генри (Уильям, англ. учён.1774-1836), открытом им в 1803 году, который гласит: "Количество растворённого в жидкости газа прямо пропорционально его давлению над раствором при постоянной температуре".
 , (1)
, (1)
где К – константа Генри, 1/ Па, 1/ бар, 1/атм;
р – общее давление, Па, бар, атм.
В случае, когда растворяется чистый газ (один компонент), то величина р будет равна общему давлению, а если растворяется смесь газов, то величина рбудет характеризует парциальное давление (рi) растворённого компонента газа в жидкости:
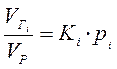 . (2)
. (2)
Закон Генри является частным случаем общего закона Дальтона.
Закон Дальтона: р = å рi
Парциальное давление компонента в смеси газов рассчитывается по формуле:
pi = pобщ ×хi, (3)
где pi – парциальное давление i-го компонента;
pобщ – общее давление газовой смеси;
Выражение (2) - выражение закона Генри–Дальтона.
VГ/VЖ Þ V2 ® объёмная доля растворённого газа, которая для идеального газа равна мольной доли (х2) Þ следствие закона Авогадро. х2= КГ ∙ р2.
Выражение закона Генри–Дальтона записывается в виде:

 (4)
(4)
где хi – мольная доля растворённого газа.
Кi – константа Генри i-го компонента газа;
pi – парциальное давление i-го компонента газа в смеси.
Уравнение(4)иная форма, с которой мы знакомились для предельно разбавленных растворов (ПРР). В реальных предельно разбавленных растворах для растворителя (х1) выполняется закон Рауля, а для растворенного жидкого вещества (х2) – закон Генри.
Для ПРР растворов жидкостей в жидкостяхсо сравнимыми давлениями насыщенных паров Генри экспериментально обнаружил, что при низких концентрациях давление пара растворённого вещества пропорционально его мольной доле
 р2 = kГ ∙ х2. (5)
р2 = kГ ∙ х2. (5)
гдеkГ –эмпирическая константа (константа Генри), имеющая размерность давления. Если сравнить выражение 5с законом Рауля (з-н Рауля Þ  ), то следует, чтоkГ @
), то следует, чтоkГ @ 
Но коэффициент пропорциональности отличен от давления насыщенного пара чистого вещества: kГ ¹роi
Константа Генри определяется как тангенс угла наклона касательной к экспериментальной кривой зависимости давления пара от состава раствора при х2 ®0.

Константа Генри определяется экстраполяцией опытных данных:
kГ = lim çр2 / х2 çпри х2 ®0.
При х2 ®1, kГ ® ро2, и мы получим закон Рауля.
Сравним эти две формы  (4)
(4)
р2 = kГ ∙ х2.(5)Þ К = 1/ kГ .
На практике растворимость газа принято выражать не в мольных долях, а в объёмных единицах по выражению (1):  ,
,  . (6)
. (6)
Отношение растворимости к давлению (при T =const) есть константа Генри:
 и она имеет физический смысл коэффициента растворимости при парциальном давлении газа равном единице, 1 бар, 1 МПа, 1 атм.
и она имеет физический смысл коэффициента растворимости при парциальном давлении газа равном единице, 1 бар, 1 МПа, 1 атм.
Мерой растворимости газа в жидкости является коэффициент растворимости (a), который характеризует количество растворённого в жидкости (растворе) газа при данных термобарических (р и Т) условиях:
a = (VГ/Vр) р, Т, (7)
где a – коэффициент растворимости газа (коэффициент Бунзена), м3/м3.
Аналитическое выражение закона Генри термодинамическим методом можно получить на основе уравнения Гиббса–Дюгема:
 , (8)
, (8)
где х1 и х2 – мольные доли растворителя (1 – жидкость) и растворённого вещества (2 – газ);
m 1 и m2 – химические потенциалы растворителя и растворённого вещества.
Химические потенциалы можно определить по следующим выражениям:
 и
и  , (9)
, (9)
где р1 и р2 – парциальные растворителя и растворённого газа.
Продифференцировав выражения (9), получим дифференциалы от химических потенциалов:
 и
и  . (10)
. (10)
Подставляем выражение (4.10) в исходное уравнение Гиббса–Дюгема (8):
 . (11)
. (11)
Выделяем dlnp2из уравнения (11):
 . (12)
. (12)
Это уравнение можно преобразовать к такому виду:
 . (13)
. (13)
Парциальное давление пара с идеальными свойствами для растворителя можно определить по закону Рауляи выразить его через давление насыщенного пара:
 . (14)
. (14)
Продифференцируем (14) по х1:  , подставим его в (13) и получим следующее уравнение:
, подставим его в (13) и получим следующее уравнение:
 или
или  . (15)
. (15)
Берём неопределённый интеграл от уравнения (15) с введением константы интегрирования lnk, где kГ – константа Генри:

 (16)
(16)
После потенцирования выражения (4.16) получаем уравнение закона Генри:
р2 = kГ×х2. (17)
На основе этого уравнения закон Генри гласит: "При постоянной температуре парциальное давление летучего (газообразного) компонента (р2) прямо пропорционально его мольной доле в жидкости (х2)".
Эта формулировка закона Генри применима для случая, когда растворённое газообразное вещество развивает бо¢льшую упругостью пара (роГ) по сравнению с упругостью пара чистого растворителя (рор), что характерно для газов. При этом оба вещества раствора (газ и растворитель) химически инертны. Размерность величины kГ в уравнении (17) такая же как и парциального давления.
Растворимость газов в жидкостях прямо пропорциональна парциальному давлению газа (рг) над поверхностью жидкости:  .
.
Константа Генри постоянна для i-го вещества при данной температуре, а при изменении температуры её значение меняется по экспоненциальному закону. Значения величин К для разных систем приводятся в справочниках по термодинамическим свойствам веществ.
В общем случае, константа Генри зависит от природы газа, природы растворителя и температуры.
В области высоких давлений (выше 1¸1.2 МПа) или когда свойства газового раствора неидеальны, что может проявляться при сравнительно высоких концентрациях растворённого газа в растворителе, то в выражении закона Генри вместо давлений используют величины фугитивностей:
fг/Кг = хг и fг = gf × pг, (18)
где fг – фугитивность (летучесть) газа;
gf – коэффициент фугитивности, зависящий от р и Т.
При высоких давлениях изменение объёма раствора становится довольно значимым и для расчёта количества растворённого в жидкости газа используют формулу Кричевского–Казарновского:
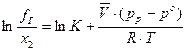 , (19)
, (19)
где  – парциальный мольный объём растворённого газа;
– парциальный мольный объём растворённого газа;
рр, ро – давление газа над раствором и давление над чистым растворителем;
х2 – мольная доля газа в жидкости.
При растворении газов в жидкостях происходит значительное уменьшение объёма газа над поверхностью раствора и поэтому повышение давления, согласно принципу Ле Шателье, приводит к увеличению количества растворённого газав жидкости.
Принцип Ле Шателье. На термодинамическую систему, находящуюся в состоянии устойчивого равновесия, могут воздействовать внешние факторы, выводящие её из этого состояния. Реакцию системы на эти воздействия можно качественно определить на основе принципа Ле Шателье–Брауна, предложенного в 1884 году французским химиком Анри Луи Ле Шателье (1850–1936 г.г.) и обоснованного в 1887 году немецким физиком Карлом Фердинандом Брауном (1850–1918 г.г.): "Внешние воздействия, выводящие термодинамическую систему из состояния устойчивого равновесия, вызывают в ней протекание процессов, которые уменьшают влияние этих внешних возмущений".
Влияние температуры
Жидкости в ближнем порядке имеют упорядоченное строение, то есть в них создаются полиэдрические структуры среднестатистического строения (тетраэдры, тригональные бипирамиды, октаэдры и др.) При растворении газов в жидкостях образуются разнородные по составу полиэдры, в которых молекулы растворённого газа могут быть окружены в первой координационной сфере молекулами растворителя с образованием тетраэдров, тригональных бипирамид, октаэдры и других, также среднестатистической структуры.
Полиэдры, включающие молекулу растворённого газа и молекулы растворителя (лиганды) в первой и последующей координационной сферах непрерывно обмениваются лигандами с молекулами растворителя из объёма. Поэтому структура полиэдров может существовать в растворе как среднестатистическая пространственная структура.
В механизме процесса растворения газа в жидкости можно выделить следующие стадии:
· диффузия молекул газа из объёма к поверхности жидкости;
· соударение молекул газа с поверхностью жидкости;
· разрушение полиэдров жидкости в поверхностном слое молекулами газа, с поглощением энергии;
· взаимодействие молекул газа с молекулами жидкости в объёме;
· образование новых полиэдров разнородного состава, с выделением энергии в объём жидкости;
· координация молекул газа с молекулами жидкости с образованием первой и других координационных сфер вокруг молекул газа в составе полиэдров;
· диффузия полиэдров в объём или эстафетная передача молекул газа от полиэдра к полиэдру.
 Первые две стадии требуют затраты небольшой энергии, а стадии по синтезу разнородного по составу полиэдра сопровождается выделением энергии в форме теплоты.
Первые две стадии требуют затраты небольшой энергии, а стадии по синтезу разнородного по составу полиэдра сопровождается выделением энергии в форме теплоты.
Поэтому при обычных давлениях растворение газа в жидкости является экзотермическим процессом(протекает с выделением теплоты) и, в соответствии с правилом Ле Шателье–Брауна, с повышением температуры равновесие смещается в сторону эндотермического процесса, а следовательно количество растворённого газа в жидкости будет уменьшаться, что показано на рисунках 1–2 и в таблицах 1–2.
Рис. 2 - Зависимость растворимости газов в воде от температуры
Растворимость кислорода в воде примерно в два раза выше, чем азота (рис. 2), поэтому воздух, растворённый в воде, примерно в два раза более богат кислородом, чем воздух атмосферы. Если между газом и растворителем нет химического взаимодействия, то обычно концентрация растворённого газа небольшая (табл. 1)..
Таблица 4.1 – Коэффициент растворимости кислорода в воде
при разных температурах
| Температура, К | Коэффициент растворимости (a), г/100 г |
| 0,04889 | |
| 0.03103 | |
| 0,01946 | |
| 0,01720 |
Некоторые газы, например, аммиак (табл. 2), взаимодействуют с водой и растворимость их в воде велика
Таблица 2 – Растворимость аммиака в воде
при разных температурах
| Температура, К | Коэффициент растворимости (a), г/л |
Растворимость углеводородов при разных давлениях в воде от температуры меняется по кривым с минимумом.

Рис. 2 - Зависимость растворимости природного газа в пресной воде от температуры при различных давлениях
С увеличением температуры растворимость углеводородов в воде уменьшается (рис. 21), достигает минимума, а затем снова возрастает.
Из приведённых выше рисунков и таблиц видно, что растворимость газа в жидкости с повышением температуры снижается.
Аналитическую зависимость растворимости газа в жидкостях от температуры можно получить методом сравнения химических потенциалов газа, находящегося над жидкостью и в растворе. Пусть в термостатированной системе "газ–жидкость" при р, Т = const газ в растворе и над поверхностью раствора находится в равновесии, как показано на рисунке 4.3.
 Рис. 4.3 - Равновесие в системе газ-жидкость
Рис. 4.3 - Равновесие в системе газ-жидкость
Равновесие в термостатированной системе характеризуется равенством химических потенциалов газа в газовой (  ) и жидкой (
) и жидкой (  ) фазах:
) фазах:
 . (20)
. (20)
Химический потенциал для газовой фазы зависит только от температуры:  , а для раствора от температуры и от мольной доли газа в растворе (х2):
, а для раствора от температуры и от мольной доли газа в растворе (х2):  , то есть выражение (20) будет выглядеть следующим образом:
, то есть выражение (20) будет выглядеть следующим образом:
 . (21)
. (21)
Дифференцируя выражение (21) по Т и х2, получим:
 (22)
(22)
Химический потенциал газа в растворе определяется по формуле:  , и производная от этого выражения будет вида:
, и производная от этого выражения будет вида:
 . (23)
. (23)
Производные по температуре можно расшифровать и записать в таком виде:


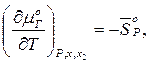 (24)
(24)
где 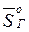 и
и  – парциальные мольные энтропии газа над жидкостью и газа в растворе, соответственно.
– парциальные мольные энтропии газа над жидкостью и газа в растворе, соответственно.
Подставив (24) в (22), получим:
 . (25)
. (25)
Откуда
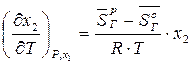 . (26)
. (26)
По 2-му закону термодинамики разность энтропий для термодинамически обратимого процесса растворения газа в жидкости будет равна теплоте его растворения, делённой на температуру (приведённая теплота):
 . (27)
. (27)
Подставив (27) в (26), получим логарифмическую зависимость растворимости газа от температуры:
 . (29)
. (29)
Для процесса растворения газа в жидкости при обычных условиях
∆НрГ < 0 (экзотермический процесс идёт с выделением теплоты), поэтому  и с повышением температуры растворимость газа в жидкости уменьшается в области невысоких температур (рис. 2). В области высоких температур величина
и с повышением температуры растворимость газа в жидкости уменьшается в области невысоких температур (рис. 2). В области высоких температур величина  и растворимость с ростом температуры увеличивается (рис. 3). Температура минимальной растворимости газов зависит и от давления.
и растворимость с ростом температуры увеличивается (рис. 3). Температура минимальной растворимости газов зависит и от давления.
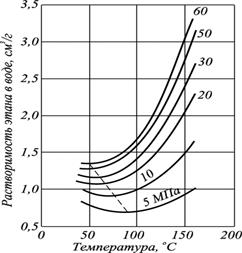
Рис. 3 - Изменение температуры минимальной растворимости
этана в воде в зависимости от давления (МПа) при 0 oС
Причём, температура минимальной растворимости различных углеводородных газов возрастает с увеличением размера молекулы газа. Коэффициент растворимости нефтяных газов (a) в воде изменяется в широких пределах и достигает 4–5·10–5 м3/(м3·Па).
(Коэффициент растворимости газа (a) показывает, какое количество газа (Vг) растворяется в единице объёма жидкости (Vж) при данном давлении:  .) Закономерность уменьшения растворимости газов в жидкостях с повышением температуры (в области невысоких температур) и увеличения растворимости газов в жидкостях при их охлаждении находится в согласии с принципом Ле Шателье, поскольку процесс растворения газов в жидкостях сопровождается выделением тепла.
.) Закономерность уменьшения растворимости газов в жидкостях с повышением температуры (в области невысоких температур) и увеличения растворимости газов в жидкостях при их охлаждении находится в согласии с принципом Ле Шателье, поскольку процесс растворения газов в жидкостях сопровождается выделением тепла.
Иногда, правда, растворение благородных газов в некоторых органических растворителях сопровождается поглощением и в этом случае нагревание способствует увеличению растворимости.