 |
|
Растворимость газов в водных растворах солей
Растворимость газов в растворах снижается в присутствии в них электролитов. Снижение растворимости газов в растворах электролитов связано с процессами сольватации ионов молекулами растворителя. Ионы в водных растворах образуются вследствие диссоциации солей. Молекулы растворителя прочнее связываются с ионами электролитов, чем с молекулами газа в растворе. Значительная часть молекул растворителя расходуется на сольватацию ионов и выключаетсяиз участия в растворении газов. Число свободных молекул растворителя в растворе снижается в процессе растворения газа и вследствие этого количество растворённого газа в жидкости уменьшается. Кроме того, сольватные оболочки имеют более высокую плотность и в этих оболочках растворение газа затрудняется.
Молекулы газа вытесняются из сольватной оболочки внутренним давлением, развиваемым в оболочке силами ММВ. Это явление называется высаливанием.
Закон, отражающий растворимость газов в растворах электролитов был открыт Сеченовым И. М. (1892 г.). В экспоненциальной форме закон выглядит следующим образом:
 , (30)
, (30)
где с(х2) – растворимость газа в растворе, содержащим электролит;
со(х2) – растворимость газа в чистом растворителе;
сэл – концентрация электролита (соли);
Кс – константа Сеченова.
Константа Сеченова, являющаяся эмпирическим коэффициентом, и зависит от природы газа, природы электролита и температуры. В выражении (4.36) все концентрации должны быть выражены в одних единицах. В логарифмическом виде закон Сеченова выглядит так:
 . (31)
. (31)
В выражении (31) отношение co(х2)/c(х2) показывает, во сколько раз снижается растворимость газа в растворе электролита относительно его растворимости в чистой воде.
Для растворов электролитов количество растворённого газа в растворе можно рассчитывать определяют с использованием ионной силы раствора (I), которая равна произведению полусуммы концентрации ионов в растворе (ci) на квадрат их заряда (zi):
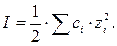 (32)
(32)
Для расчёта количества растворённого газа в растворе с ионной силой (I) и концентрацией недиссоциированных молекул электролита (cэл) уравнение используется в такой форме:
 , (33)
, (33)
где a и b - коэффициенты, которые определяют на основе опытных данных.
Концентрация солей оказывает значительное влияние на вид кривых, определяющих зависимость растворения газа в водном растворе.
Например, из эксперимента известно, что при давлении 3,5 МПа и температуре 35 °С нефтяной газ растворяется в воде (Vг/Vж) в количестве = 1 м3/м3. При повышении давления в 10 раз, до 35 МПа, растворимость газа увеличилась всего в 4 раза и составляет 4 м3/м3. То есть с повышением давления газа растворимость в водном растворе снижается вследствие проявления эффекта высаливания.
С увеличением давления возрастает также и растворимость солей в воде, то есть увеличивается их концентрация. При увеличении концентрациисолей в воде растворимость газов, в том числе и углеводородных в растворе уменьшается, как показано на рисунке 8 на примере пластовой воды.

Общее содержание солей в пластовой воде, масс. %·10–6
Рис. 8 - Изменение растворимости природного газа в
пластовой воде в зависимости от концентрации
в ней солей, цифрами обозначена температура
 Растворимость углеводородов в воде не подчиняется закону Генри для широкого интервала изменения давления, так как форма кривых нелинейная. Содержание солей в воде является одним из факторов отклонения зависимости растворимости углеводородов в растворе электролитов от линейного вида (рис. 4.9).
Растворимость углеводородов в воде не подчиняется закону Генри для широкого интервала изменения давления, так как форма кривых нелинейная. Содержание солей в воде является одним из факторов отклонения зависимости растворимости углеводородов в растворе электролитов от линейного вида (рис. 4.9).
Рис. 4.9 - Кривые, отражающие растворимость УВ газа в чистой и солёной воде при различных температурах и давлениях:
1, 2 – дистиллированная вода;
3, 4 – 2М раствор NaCl
Растворимость углеводородного газа (м3/м3) в минерализованной воде рассчитывают также по эмпирическим формулам, одна из которых приведена ниже:
aпл вод = aпресн вод·(1 – k·с), (44)
где aпл вод – растворимость нефтяного газа в пластовой воде;
aпресн вод – растворимость нефтяного газа в пресной воде;
k – поправочный коэффициент на содержание солей в зависимости от температуры (табл. 6);
с – содержание солей, масс. %.
Таблица 6 - Значения поправочных коэффициентов на
минерализацию в зависимости от температуры
| Температура, оС | |||||
| Коэффициент, k | 0,091 | 0,074 | 0,050 | 0,044 | 0,033 |
Различают физическую и химическую абсорбцию. При физической абсорбции происходит распределение молекул газа в объёме жидкости за счёт диффузии или броуновского движения.
Абсорбция, сопровождаемая химической реакцией растворённого газа с молекулами жидкости, называют хемосорбцией.
Поэтому в процессах, связанных с хемосорбцией выделяют две стадии растворения газов. Одна из стадий связана с ММВ молекул газа с молекулами растворителя. Вторая стадия связана с процессом хемосорбции, является стадия проявления сил Ван дер Вальса, как следствие химической реакции молекул газа с молекулами растворителя.
Так, молекулы кислорода растворяются в воде в результате межмолекулярного взаимодействия физической природы этих молекул с молекулами воды. Это отражает относительно плохую растворимость О2 в воде. Малой растворимостью в воде обладают благородные газы: He, Ne, а также неполярные молекулы типа H2, CH4 и др. Однако, даже незначительная растворимость кислорода в воде играет решающее значение для жизни биологических организмов в воде.
Высокая растворимость полярных газов в воде определяется их химическим взаимодействием с растворителем. Например, аммиак хорошо растворяется в воде (табл. 4.2) вследствие протекания химической реакции с образованием гидроксиламмония с последующим распадом на катион аммония:
NH3 + H2O = NH4ОН, NH4ОН « NH4+ + OH-. (45)
 |
В водном растворе ионы аммония, а также гидроксилионы сольватируются полярными молекулами воды (рис. 4.10), с созданием полиэдров с первой, 2-ой, 3-ей т.д. координационными сферами.
Рис. 4.10 - Схема сольватированного катиона аммония
Углекислый газ также хорошо растворяется в воде вследствие проявления межмолекулярных взаимодействий и физической природой с последующей химической реакции образования угольной кислоты и последующим распадом на ионы:
СО2 + H2O = H2СО3, H2СО3 « HСО3- + H+. (46)
Растворимость хлористого водорода (HCl) в воде является достаточно высокой, вследствие образования соляной кислоты и диссоциации её на ионы по схеме:
HCl + aq = HCl×aq = H+aq + Сl-aq. (47)
Равновесие в системе «жидкость - газ» является динамическим, которое определяет, что количество молекул, уходящие с поверхности жидкости в единицу времени равно количеству молекул пара, возвращающихся в раствор. Скорость испарения жидкости равна скорости конденсации пара или газа: Vисп = Vконд. Равновесное давление определяется как давление насыщенного пара или газа.