 |
|
Для бинарного раствора уравнение (3) можно представить
х1 + х2 = 1 Þ х2 = 1 - х1 Þ(3)
 (4)
(4)
В (4) раскроем скобки и сгруппируем члены при х1:
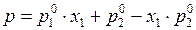
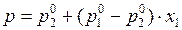 .(5)
.(5)
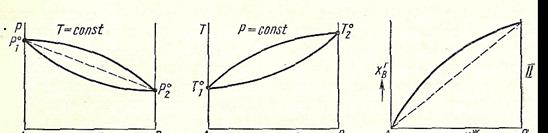
Уравнение (5) выражает зависимость общего давления от состава жидкой фазы.Общее давление при фиксированной Т меняется линейноот р1о дор2опри изменении х1от0до1.
Для идеального раствора состав паровой фазылегко установить, знаясостав жидкой фазы,если пар(смесь идеальных газов)и находится в равновесиис идеальным раствором.
Состав пара будет отличаться от состава жидкого раствора, из которого он получен.
Только для случая, когдаро1 = ро2,состав пара одинаков с составом жидкого раствора. Во всех остальных случаях, даже для идеальных растворов, состав пара будет отличаться от состава жидкого раствора.
По определению парциальных величин (закон Дальтона) ® pi = p × уi.
Состав насыщенного пара определяется мольными долями компонентов в паровой фазе у1 и у2:
у1 =  , у2 =
, у2 = 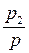 . (6)
. (6)
Выведем зависимость общего давления от состава паровой фазы.
Закон Рауля: 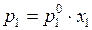 и
и  .
.
Закон Дальтона: p1 = p × у1. и p2 = p × у2.
Приравняем правые
 .(7)
.(7)
Выразим мольную долю х1 из (7) иподставим в соотношение(5): 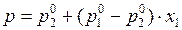 Þ
Þ
 . (8)
. (8)
Приведём (8) к общему знаменателю:
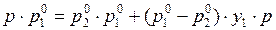 . (9)
. (9)
В (9) выделим члены с ри соберём их в левой части выражения:
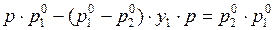 . (10)
. (10)
Сгруппируем слагаемые в левой части и вынесем р за скобки, при этом поменяем знак:
 . (11)
. (11)
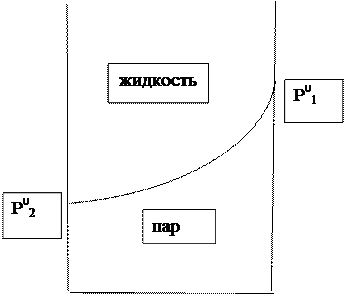
Получим выражение общего давления от состава парав видегиперболы:
 (12)
(12)
 |
0 у1 1
Эта кривая является фазовой диаграммой, так как представляет собой границу между стабильными областями двух фаз.
Мы можем пользоваться любой диаграммой и свободны в выборе переменных состава: у2 = 1 – у1.
Если нас на фазовой диаграмме интересует газ, то на оси абсцисс работаем с у, а если жидкость, то выбираем х.
Связь между значениями у и х определяется по уравнению Д.–Р.:
 Þ
Þ  ,
, 
Но есть вопросы и задачи, когда нас интересует и состав жидкости и состав пара - дистилляция, тогда эти обе фазовые диаграммы соединяем в одну.

Зависимость полного давления пара идеального раствора от мольной доли компонента В во всей области составов.
Для изучения равновесия "пар-жидкость" применяют 2 типа диаграмм:
р = ¦ (х) при Т = const или Т = ¦(х) при р = const,
Диаграммы равноценны, однако чаще используются диаграммы
Т = ¦(х) при р = const,их называютдиаграммы кипения.
Любая точка на плоскости диаграммы характеризует валовый состав системы (координата х) итемпература (координата Т) и называется фигуративной точкой.
На диаграмме нижняя линия – линия кипения раствора. Любая фигуративнаяточка, лежащая на кривой кипения характеризует состав кипящей жидкости и температуру, при которой кипит жидкость заданного состава (при р = const).
Раствор кипит, когда общее давление пара над раствором равно внешнему давлению. Если внешнее давление равно 1 бар, то Ткип – называют стандартной температурой кипения (ТСТК). Если р = 1 атм., то Ткип – называют нормальной температурой кипения (ТНТК). (1 бар = 0,987 атм).
Верхняя линия в виде параболы показывает состав пара, равновесного с жидкостью – линия конденсации. Любая фигуративнаяточка, лежащая на этой линии характеризует состав пара и температуру, при которой появляется первый пузырёк пара кипит жидкость заданного состава (при р = const).
Нижняя и верхняя кривые разделяют плоскость диаграммы на три поля.
Центральная область отвечает гетерогенному состоянию системы, когда одновременно сосуществуют насыщенный пар и микрокапельки жидкости.
За пределами этой области стабильна только одна фаза.
Состав жидкой и паровой фаз определяется координатами точек, лежащих на пересечении изотермыили изобары, проходящей через фигуративную точку системы, с верхней и нижней кривыми по правилу рычага.
Изотермыили изобары – горизонтальные линии,которыепараллельны оси абсцисси называютсянодойили конодой. любой фигуративной точке
Правило рычага.
  |
Правило рычага отражает материальный баланс и получило своё название от аналогичного механического условия равновесия масс относительно центра рычага. Чтобы определить составнеобходимо измерить расстояние вдоль горизонтальной конноды. Длины отрезков Lжид и Lпар используются для определения соотношения фаз жидкости и пара в равновесной смеси:
nжид × Lжид = nпар × Lпар
Поле, заключенное между двумя кривыми, соответствует двухфазной системе. Система, давление и состав которой отображает фигуративная точка, находящаяся в этом поле, состоит из двух фаз – раствора и насыщенного пара. Состав. Например, система, характеризуемая фигуративной точкой k, состоит из двух равновесных фаз, состав которых определяется точками а и b. Точка а, лежащая на нижней кривой, характеризует состав насыщенного пара, а точка b, лежащая на верхней кривой,– состав раствора. Нижняя кривая называется ветвью пара, верхняя кривая – ветвью жидкости.

Рис. 8 – Диаграмма состав – давление бинарной системы.
При изотермическом сжатии ненасыщенного пара состава х1фигуративная точка системы движется вверх по вертикали, конденсация пара начинается в точке а (рис. 8) при известном значении давления P. Первые капли жидкости имеют состав х2;образовавшаяся жидкость содержит меньше компонента А, чем конденсирующийся пар.
При изотермическом уменьшении давления жидкость состава х3начнет испаряться в точке d, давая пар состава x4 (точка е); образовавшийся пар содержит больше компонента А, чем испаряющаяся жидкость.
Следовательно, в паре всегда преобладает по сравнению с равновесной с ним жидкостью компонент А, прибавление которого к системе, как это видно из диаграммы, увеличивает полное давление.
Реальные растворы
Жидкие реальные растворы показывают положительные и отрицательные отклонения от растворов с идеальными свойствами.
Если значение общего давлениянасыщенного пара больше, чем пары растворов с идеальными свойствами, тоотклонениясчитаютсяположительными (F1-1 > F1-2 < F2-2).
На рис. приведены зависимости полного давления пара реальногораствора от мольной доли компонента В во всей области составов с незначительными положительными отклонениями от свойств растворов с идеальными свойствами.


Оба вида фазовых диаграмм имеют вид гиперболы.
Если значение общего давлениянасыщенного пара меньше, чем пары растворов с идеальными свойствами, то отклонениясчитаютсяотрицательными (F1-1< F1-2 > F2-2).
На рис. приведены зависимости полного давления пара реальногораствора от мольной доли компонента В во всей области составов с незначительными отрицательными отклонениями от свойств растворов с идеальными свойствами.

Для рассмотренных типов растворов выполняется 1-ый закон Коновалова: пар обогащается более летучим компонентом.
При увеличении отклонения от идеальности может появиться минимум при отрицательных отклонениях или максимумпри положительных отклонениях на кривых зависимости полного давления пара реальногораствора от мольной доли компонента В.

Чем больше разность значений р1о и р2оили температур кипения(Т1кип и Т2кип), тем большими должны быть отклонения для образования экстремума.

Рис – зависимости полного давления пара реальногораствора от мольной доли компонента В во всей области составов со значительными положительными отклонениями от свойств растворов.
Зависимости с максимумом характерны для веществ, способных к ассоциации.
Точка экстремума получила название азеотроп (нераздельнокипящая смесь). Такие растворы называются азеотропнымисмесями. Такие растворы имеют самую низкую температуру кипения. Азеотропная смесь не является химическим соединением. Азеотропная смесь являются смесями с предельными отклонениямиот идеальности и полной взаимной растворимостью .
Для таких смесей по-прежнему соблюдается первый закон Коновалова.
Однако для них выполняется и второй закон Д.П. Коновалова:
Чем неприятен азеотроп? Например: Н2О – С2Н5ОН Тводакип – 100 оС, Тспирткип – 78,3 оС. Состав азеотропа – 96 % и его не разделить.