 |
|
Примеры решения типовых задач
Пример 1.Расчет концентрации вещества.
В 1 л воды растворили 142 г сульфата натрия. Плотность полученного раствора равна 1,1 г/мл. Определить процентную, молярную, моль-эквивалентную, моляльную концентрации и мольные доли компонентов в полученном растворе.
Решение. 1. Определяем процентную концентрацию:

2. Определяем молярную и моль-эквивалентную концентрации:


3. Определяем моляльную концентрацию:

4. Определяем мольные доли компонентов:
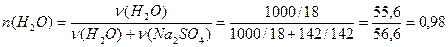

Пример 2.Какие массы 10% и 30% растворов серной кислоты необходимо взять, чтобы приготовить 600 г 20% раствора серной кислоты.
Решение.
1. Обозначим массу 10% серной кислоты через х, а массу 30% кислоты через y. Тогда масса растворенной серной кислоты в первом растворе равна 0,1х, а во втором - 0,3у.
2. По условию задачи х+у= 600г, а 0,1х+0,3у=600×0,2=120г. При решении системы полученных уравнений получаем: х= у =300 г.
Пример 3.Сколько граммхлорида натрия выпадет в осадок при охлаждении до 0°С из 600 г насыщенного при 80°С раствора, если растворимость соли при 80°С равна 38 г, а при 0°С – 35,8 г.
Решение.
1. По определению растворимости в 138 г насыщенного при 80°С раствора содержится 38 г растворенного вещества, а в 600 г:  г. Следовательно, масса воды в данном растворе равна: m(H2O)=600-165,2=434,8г.
г. Следовательно, масса воды в данном растворе равна: m(H2O)=600-165,2=434,8г.
2. При 0°С в 100 г воды растворяется 35,8 г соли, а в 434,8: 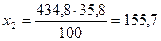 г.
г.
3. При охлаждении раствора выпадет в осадок: m(NaCl)=165,2-155,7=9,5 г.
Пример 4.При какой температуре будет кристаллизоваться 40% (по массе) раствор этилового спирта?
Решение.
1. Считаем массу раствора равной 100г, тогда масса спирта в растворе равна 40г, а его количество и моляльная концентрация :  ,
, 
2. По второму закону Рауля  , следовательно tзам=-27°С.
, следовательно tзам=-27°С.
Пример 5. Найти давление пара над раствором, содержащим 13,68 г сахарозы в 90 г воды, если давление насыщенного пара над водой равно при данной температуре равно 25,0 кПа.
Решение.
1. Относительное понижение давления над раствором определяется мольной долей растворенного вещества. Мольная доля сахарозы 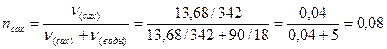 .
.
2. Первый закон Рауля : 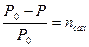 , отсюда
, отсюда 
Пример 6. В равных количествах воды растворено в одном случае 0,5 моль глюкозы, во втором – 0,2 моль хлорида бария. Температуры кипения обоих растворов одинаковы. Определить кажущуюся степень диссоциации хлорида бария.
Решение.
1. Поскольку температуры кипения растворов одинаковы, а растворитель один и его количество не меняется , можем написать 0,5= 0,2 i.
Отсюда i =2.5.
2. Учитывая связь степени диссоциации и изотонического коэффициента, а также, что при диссоциации хлорида бария образуется три частицы, получаем:  .
.
Пример 7. Константа диссоциации масляной кислоты равна 1,5 10-5. Вычислить ее степень диссоциации и рН в 0,005 М растворе.
Решение.
1. Связь степени и константы диссоциации слабого электролита выражается законом разбавления Оствальда: 
2. Показатель кислотности рН:  .
.
Пример 8.Произведение растворимости хромата серебра при 20 С равно 4×10-12. Найти растворимость соли (в моль/л и в г/л).
Решение.
1. Обозначим растворимость через s (моль/л). В насыщенном растворе Ag2CrO4 содержится s мольл/л ионов CrO42- и 2s моль/л ионов Ag+. Отсюда 
2. Так как молярная масса Ag2CrO4 равна 332 г/моль, то растворимость, выраженная в г/л, составит 332×10-4=0,0332 г/л.
Пример 10. Выпадет ли осадок при смешении равных объемов 0,01 М растворов хлорида натрия и нитрата серебра, если произведение растворимости AgCl равно 1,8 ×10-10.
Решение.
1. При смешении растворов хлорида натрия и нитрата серебра суммарный объем раствора увеличится в 2 раза, значит концентрация ионов серебра и хлора уменьшится в двое и станет равной 0,005 моль/л.
2. Произведение ионов: ПИ=[Ag+][Cl-]= 0,005×0,005=2,5 ×10-5.
3. Осадок выпадает, т.к. ПИ>ПР.
Пример 11.Вычислить рН раствора и степень гидролиза ацетата натрия в 0,01 М растворе. Константа диссоциации уксусной кислоты равна 1,8×10-5.
Решение.
1. Гидролиз ацетата натрия протекает по уравнению:
CH3COONa+H2O ↔CH3COOH + NaOH , для вычисления степени гидролиза определяем константу гидролиза. 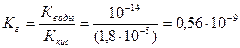
2.Степень гидролиза 
3. Показатель кислотности:  .
.