 |
|
Способы выражения концентрации растворов
Важной характеристикой любого раствора служит содержание в нем растворенного вещества. Состав раствора (и, в частности, содержание в нем растворенного вещества) может выражаться разными способами - как с помощью безразмерных единиц (долей или процентов), так и через размерные величины - концентрации.
Существуют следующие способы выражения содержания растворенного вещества в любом растворе:
1. Массовая доля растворенного вещества - это отношение массы данного вещества в растворе к общей массе раствора:
 , где
, где
 - массовая доля вещества Х;
- массовая доля вещества Х;  - масса вещества Х;
- масса вещества Х;  - общая масса раствора.
- общая масса раствора.
Массовая доля является безразмерной величиной. Ее выражают в долях от единицы, в процентах или промилле. Например, водный раствор соляной кислоты  с массовой долей 10% содержит 10 единиц массы
с массовой долей 10% содержит 10 единиц массы  в 100 единицах массы раствора. Следовательно, в 100 единицах массы раствора содержится 10 единиц массы растворенного вещества (в данном случае
в 100 единицах массы раствора. Следовательно, в 100 единицах массы раствора содержится 10 единиц массы растворенного вещества (в данном случае  ) и 90 единиц массы растворителя (в данном случае воды).
) и 90 единиц массы растворителя (в данном случае воды).
Массовую долю, выраженную в процентах, называют процентной концентрацией. Процентная концентрация - это весовая концентрация.
2. Молярная доля - отношение количества растворенного вещества или растворителя к сумме количеств всех веществ, составляющих раствор. В случае раствора одного вещества в другом молярная доля растворенного вещества N2 равна:

А молярная доля растворителя N1: 
где  и
и  - соответственно количества вещества растворителя и растворенного вещества.
- соответственно количества вещества растворителя и растворенного вещества.
3. Молярная концентрация - это отношение количества растворенного вещества в молях к объему раствора:  (1)
(1)
где  - молярная концентрация частиц Х;
- молярная концентрация частиц Х;  - количество вещества частиц Х, содержащихся в растворе, определяется численностью содержащихся в растворе частиц Х, которые могут быть атомами, молекулами, ионами, электронами, атомными группами, эквивалентами;
- количество вещества частиц Х, содержащихся в растворе, определяется численностью содержащихся в растворе частиц Х, которые могут быть атомами, молекулами, ионами, электронами, атомными группами, эквивалентами; 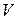 - объем раствора.
- объем раствора.
Для определения количества вещества Х нужно массу вещества  разделить на молярную массу вещества, состоящую из частиц Х:
разделить на молярную массу вещества, состоящую из частиц Х:  (2)
(2)
Подставив значение  в формулу (1), будем иметь:
в формулу (1), будем иметь:  .
.
Молярная концентрация равна массе, деленной на произведение молярной массы и объема раствора. Например, если в колбе объемом 2 л будет 80 г NaCl, то его молярная концентрация определится отношением: 
Обычно применяют для выражения молярной концентрации выражение моль/л. Таким образом, молярная концентрация выражается в молях и является объемной концентрацией.
4. Моляльная концентрация - отношение количества растворенного вещества к массе растворителя. Обычно моляльность обозначается буквой m. Например, если для раствора гидроксида натрия NaOH запись m=3 моль/кг (Н2О) означает, что в этом растворе на каждый килограмм растворителя (воды) приходится 3 моля NaOH. Моляльность раствора, в отличие от молярности не изменяется при изменении температуры.
5. Нормальная (эквивалентная) концентрация - отношение числа эквивалентов (грамм-эквивалентов) растворенного вещества к объему раствора. Концентрация, выраженная этим способом, обозначается 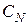 или N, а после численного значения нормальности н. Например, 2 н. H2SO4 означает, что в каждом литре такого раствора содержится 2 эквивалента серной кислоты, т.е.
или N, а после численного значения нормальности н. Например, 2 н. H2SO4 означает, что в каждом литре такого раствора содержится 2 эквивалента серной кислоты, т.е. 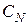 (1/2 H2SO4)=2 моль/л.
(1/2 H2SO4)=2 моль/л.
Эквивалент - это реальная или условная частица вещества, которая
а). в кислотно-основной реакции (реакции нейтрализации) эквивалентна одному иону водорода или одному иону гидроксила, образующих воду. Например:

Здесь шести ионам водорода (в трех реагирующих частицах H2SO4) соответстуют две частицы Al(OH)3, следовательно, одному иону водорода эквивалентна 1/3 частицы Al(OH)3, т.е. один эквивалент Al(OH)3 равен 1/3 частицы Al(OH)3.
б). в окислительно-восстановительной реакции одному электрону, который молекула вещества приобретает или отдает в данной реакции:

Т.е, на 1 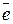 приходится 1/5 MnO4-, являющаяся эквивалентом для KMnO4 в данной реакции.
приходится 1/5 MnO4-, являющаяся эквивалентом для KMnO4 в данной реакции.
в). в реакциях осаждения и комплексообразования соответствует 1 иону одновалентного металла, ½ иона двухвалентного металла и т.д., образующих осадок или комплексное соединение. Так при титровании цианида солью серебра по Мору:
 эквивалент KCN равен его молекуле,
эквивалент KCN равен его молекуле,
а при титровании по Дениже:
 эквивалент KCN равен двум молекулам.
эквивалент KCN равен двум молекулам.
Существуют еще следующие определения понятия эквивалента.
- для кислоты эквивалент соответствует основности (числу атомов водорода в составе) кислоты, обмениваемых в данной реакции на металл или нейтрализуемых основанием.
- для основания эквивалент соответствует кислотности (числу гидроксогрупп в составе) основания, обмениваемых на кислотный остаток или нейтрализуемых кислотой.
- для солей эквивалент рассчитывают как произведение числа атомов и степени окисления металла в составе соли.
- для окислителей и восстановителей в окислительно-восстановительных реакциях эквивалент равен изменению их степени окисления в ходе реакции.
В любом случае, эквивалент вещества не является величиной постоянной, а зависит от реакции, в которой это вещество принимает участие.
6. Титромназывается количество грамм растворенного (титрующего) вещества в 1 мл раствора. Подобным выражением концентрации пользуются в аналитической химии для выражения концентрации так называемых стандартных растворов (титрантов), используемых в аналитической химии для различных видов титриметрического анализа.
7. Поверхностнойконцентрацией называется отношение числа частиц компонента, его количества или массы на поверхности системы к площади этой поверхности. Единицы измерения, соответственно, м-2, моль/м2 или кг/м2.
8. В неоднородных системах различают средние (общие) и локальные концентрации компонентов.