 |
|
Химическая кинетика и равновесие
Пример 1. Реакция между оксидом азота (II) и хлором протекает по уравнению: 2NO + Cl2 ⇄ 2NOCl. Как изменится скорость данной элементарной реакции при увеличении а) концентрации оксида азота (II) в два раза; б) давления в 2 раза?
Решение:
а) Обозначим концентрации NO и Cl2 соответственно через a и b. В соответствии с законом действующих масс выражение для скорости реакции имеет вид: v1=ka2b. После увеличения концентрации NO в два раза она будет равна 2a, поэтому v2=k(2a)2b=k4a2.b. Увеличение скорости реакции по отношению к первоначальной определяется соотношением: 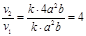 .
.
б) Увеличение давления во столько же раз повышает концентрации газообразных веществ NO и Cl2. Они соответственно станут равными 2a и 2b. Поэтому
v2=k(2a)2 2b=k8a2.b.
Увеличение скорости реакции составит:  .
.
Ответ: Увеличится а) в 4 раза; б) в 8 раз.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
 ,
,
где  и
и  – скорость реакции при температуре Т1 и Т2 соответственно, Т2>Т1; γ – температурный коэффициент скорости реакции, показывающий во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 0С. Для большинства реакций при обычных температурах значения γ находятся в пределах 2-4.
– скорость реакции при температуре Т1 и Т2 соответственно, Т2>Т1; γ – температурный коэффициент скорости реакции, показывающий во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 0С. Для большинства реакций при обычных температурах значения γ находятся в пределах 2-4.
Пример 2. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 50 раз? Температурный коэффициент скорости реакции равен 1,8.
Решение:
Найдём значение ΔТ=Т2 - Т1, при котором отношение: v2/v1=50.
Согласно правилу Вант-Гоффа  , отсюда
, отсюда
 или
или 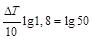 . Следовательно, ΔТ=67 0С.
. Следовательно, ΔТ=67 0С.
Ответ: На 67 0С.
Как следует из уравнения Вант-Гоффа, скорость реакции сильно возрастает с повышением температуры. Это связано с тем, что элементарный акт химической реакции протекает не при всяком столкновении реагирующих молекул: реагируют только те молекулы (активные молекулы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных частицах и тем самым создать возможность образования новых молекул. Поэтому каждая реакция характеризуется определённым энергетическим барьером. Для его преодоления необходима энергия активации – некоторая избыточная энергия (по сравнению со средней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т.е. привело бы к образованию нового вещества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
Зависимость константы скорости реакции k от температуры выражается уравнением Аррениуса:
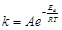 ,
,
где А – постоянная величина для данной реакции; е – основание натурального логарифма (е=2,718); R – универсальная газовая постоянная (8,314 Дж·моль-1·К-1); Т – температура, К; Еа – энергия активации.
Как следует из уравнения Аррениуса, константа скорости реакции тем больше, чем меньше энергия активации.
Скорость химической реакции возрастает в присутствии катализатора. Действие катализатора объясняется тем, что при его участии возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции понижается и активными становятся некоторые молекулы, энергия которых была недостаточна для осуществления реакции в отсутствии катализатора. В результате общее число активных молекул возрастает, скорость реакции увеличивается.
Как следует из уравнения Аррениуса, в которое Еа входит в качестве показателя степени, даже небольшое уменьшение энергии активации приводит к значительному возрастанию скорости реакции. Так, под действием биологических катализаторов – ферментов – энергия активации химических реакций, протекающих в живых организмах, резко снижается, и эти реакции достаточно быстро протекают при сравнительно низких температурах.
Пример 3. Чему равна энергия активации реакции, если при повышении температуры от 290 до 300К скорость её увеличится в 2 раза?
Решение:
Обозначим константы скорости реакции при 290 и 300К соответственно k1 и k2. Используя уравнение Аррениуса, находим:
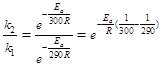 .
.
Известно, что k2/k1=2, отсюда 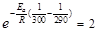 .
.
Выражаем из последнего соотношения энергию активации:
 ;
;
 .
.
Ответ: 48,0 кДж.
При протекании химической реакции концентрации исходных веществ уменьшаются. В соответствии с законом действующих масс это приводит к уменьшению скорости реакции. Если реакция обратима, т.е. может протекать как в прямом, так и в обратном направлении, то с течением времени скорость обратной реакции будет возрастать, так как увеличиваются концентрации продуктов реакции. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия. Концентрации реагирующих веществ, установившиеся к моменту наступления равновесия, называются равновесными, они остаются постоянными до нарушения химического равновесия.
Для любой системы, например,

скорости прямой и обратной реакции можно выразить согласно закону действующих масс: v1=k1[SO2]2[O2] и v2=k2[SO3]2.
С наступлением равновесия v1=v2 или k1[SO2]2[O2]=k2[SO3]2. Отсюда

Отношение констант скоростей прямой и обратной реакций называют константой равновесия К. Константа равновесия – постоянная для данной температуры величина, которая также равна произведению равновесных концентраций продуктов реакции, делённому на произведение равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам. Значение константы равновесия определяет глубину превращения исходных веществ в продукты реакции при данной температуре. При К>>1 произведение концентраций полученных веществ много больше произведения концентраций исходных веществ, поэтому обратимая реакция даёт в этом случае большой выход продуктов реакции. При К<<1, наоборот, выход продуктов реакции очень мал. В первом случае равновесие системы сильно смещено в сторону образования продуктов реакции, а во втором – в сторону исходных веществ.
В химической термодинамике доказывается, что для общего случая химической реакции
aA + bB +…→ cC + dD +…
справедливо аналогичное выражение для константы равновесия химической реакции
 .
.
Константа равновесия связана с изменением основных термодинамических характеристик соотношением:
-RTlnK=ΔG, отсюда lnK=-ΔG/RT.
Чем отрицательнее значения ΔG, тем численно больше константа равновесия, тем сильнее смещается равновесие вправо и, наоборот, чем больше положительные значения ΔG, тем сильнее равновесие смещается влево
В выражении константы равновесия гетерогенной реакции, как и в выражение закона действующих масс для скорости реакции, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными. Так, для реакции:
2PbO + O2→2PbO2 v=k[O2].
Для равновесной системы: C + O2 ⇄ 2CO константа равновесия:
 .
.
Катализатор не влияет на значение константы равновесия, поскольку он одинаково снижает энергию активации прямой и обратной реакций и поэтому одинаково увеличивает их скорость. Катализатор лишь ускоряет достижение равновесия, но не влияет на количественный выход продуктов реакции.
Пример 4. Вычислите равновесную концентрацию H2 и I2 в системе: 2HI ⇄ H2 + I2, если исходная концентрация HI составляла 0,05 моль/л, а константа равновесия К=0,02.
Решение:
Представим молярный состав системы к моменту наступления равновесия:
2HI ⇄ H2 + I2
Исходные концентрации, моль/л 0,05 - -
Прореагировало, моль/л 2x - -
Образовалось, моль/л - x x
Равновесные концентрации, моль/л (0,05-2x) x x
Запишем выражение для константы равновесия:
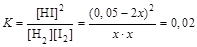 . Отсюда x=5,5·10-3 моль/л.
. Отсюда x=5,5·10-3 моль/л.
Ответ: [H2]=[I2]= 5,5·10-3 моль/л.
Пример 5.Равновесные концентрации веществ, участвующих в реакции: 2NO + O2 ⇄ 2NO2 были равны (в моль/л): [NO]=0,060; [O2]= 0,030; [NO2]=0,046. Вычислите исходные концентрации NO и O2.
Решение:
Согласно стехиометрическому уравнению реакции на образование 2 моль/л NO2 требуется 2 моль/л NO и 1 моль/л O2. Ниже представлен молярный состав системы к моменту наступления равновесия:
2NO + O2 ⇄ 2NO2 Исходные концентрации, моль/л 0,106 0,053 -
Прореагировало, моль/л 0,046 0,023 -
Образовалось, моль/л - - 0,046
Равновесные концентрации, моль/л 0,060 0,030 0,046
Исходные концентрации NO и O2 равны сумме прореагировавших и оставшихся равновесных концентраций.
Ответ: Исходные концентрации NO и O2 соответственно равны 0,106 и 0,053моль/л.
При изменении условий протекания реакции (температуры, давления, концентрации какого-либо из участвующих в реакции веществ) скорости прямого и обратного процессов изменяются неодинаково, и химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из возможных направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в том направлении, в котором оказанное воздействие будет ослаблено.
Так, повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т.е. охлаждением системы. Повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ в направлении, приводящем к понижению давления. Удаление из системы одного из продуктов реакции ведёт к смещению равновесия в сторону прямой реакции. Уменьшение концентрации одного из исходных веществ приводит к сдвигу равновесия в направлении обратной реакции.
Пример 5. Как повлияет на выход хлора в системе:
4HCl (г) + O2 (г) ⇄ 2Сl2 (г) + 2H2O (ж); ΔH0=-202,4 кДж
а) повышение температуры в реакционном объёме; б) уменьшение общего объёма системы; в) уменьшение концентрации кислорода;
г) увеличение объёма раствора; д) введение катализатора?
Решение:
а) Данная реакция протекает с выделением теплоты (ΔH0<0), поэтому согласно принципу Ле Шателье выход хлора увеличится при понижении температуры до такого её значения, при котором скорость реакции ещё достаточна для относительно быстрого достижения равновесия.
б) Протекание реакции в прямом направлении сопровождается уменьшением общего числа молей газообразных веществ, т.е. понижением давления в системе. Уменьшение общего объёма системы приведёт к повышению давления, а значит, вызовет смещение равновесия в сторону прямой реакции – увеличения выхода хлора.
в) Уменьшение концентрации кислорода - одного из исходных веществ, приведёт к сдвигу равновесия в направлении обратной реакции, т.е. понизит выход хлора.
г) Увеличение объёма раствора
д) Введение катализатора лишь ускоряет достижение равновесия, но не влияет на количественный выход продуктов реакции.
Контрольные вопросы
81. Окисление углерода и его оксида протекает по уравнениям:
а) С (т) + 1/2O2 (г) =CO (г);
б) CO (г) + 1/2O2 (г) = CO2 (г).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в 4 раза?
(Ответ: увеличатся: а) в 1,4 раза; б) в 2,8 раза )
82. Реакция идет по уравнению H2 + I2 ⇄ 2HI. Константа скорости этой реакции при 508 0С равна 0,16. Исходные концентрации реагирующих веществ были: С0(H2)=0,04 моль/л; С0(I2)=0,05 моль/л. Вычислите начальную скорость реакции и ее скорость в момент, когда концентрация H2 стала равной 0,03 моль/л.
(Ответ: 3,2×10-4; 1,92×10-4)
83. Реакция идет по уравнению 2NO + O2 = 2NO2. Концентрации исходных веществ были: С0(NO)=0,03 моль/л, С0(O2)=0,05 моль/л. Как изменится скорость реакции, если увеличить концентрацию кислорода до 0,10 моль/л, а концентрацию NO до 0,06моль/л?
(Ответ: увеличится в 8 раз)
84. Напишите выражение для константы равновесия гетерогенной реакции CO2 + C ⇄ 2CO. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в 4 раза? Как следует изменить давление, чтобы повысить выход СО? (Ответ: уменьшится в 4 раза)
85. Для практической остановки реакции применяют быстрое охлаждение реакционной смеси («замораживание реакции»). Определите, во сколько раз изменится скорость реакции при охлаждении реакционной смеси с 40 до –10 0С, если температурный коэффициент скорости реакции равен 2,7. (Ответ: в 143,5 раза)
86. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 0С, если температурный коэффициент скорости данной реакции равен двум?
(Ответ: увеличится в 64 раза)
87. Две реакции протекают при 25 0С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, а второй – 2,5. Найдите соотношение скоростей v2/v1 этих реакций при 95 0С. (Ответ: v2/v1 =4,77)
88. Энергия активации реакции O3(г) + NO(г) = O2(г) + NO2(г) равна 10 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 37 0С? (Ответ: В 1,14 раза)
89. Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергию активации реакции уменьшить на 4 кДж/моль? (Ответ: В 5 раз)
90. Реакция идет по уравнению 2NO + O2 ⇄ 2NO2. Концентрации исходных веществ до начала реакции были: С0(NO)=0,049 моль/л; С0(O2)=0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда концентрация NO стала равной 0,005 моль/л. (Ответ: [NO]=0,039 моль/л; [О2]=0,005 моль/л)
91. Реакция идет по уравнению N2 + 3H2 ⇄ 2NH3. Концентрации участвующих веществ были: [N2] - 0,80 моль/л; [H2] - 1,5 моль/л; [NH3] - 0,01 моль/л. Вычислите концентрации водорода и аммиака, когда концентрация азота стала равной 0,50 моль/л.
(Ответ: [NH3]=0,70 моль/л; [H2]=0,60 моль/л)
92. Равновесие в гомогенной системе:
4HCl(г) + O2(г) ⇄ 2H2O(г) + 2Cl2(г)
установилось при следующих концентрациях реагирующих веществ: [H2O]=0,14 моль/л; [Cl2]=0,14 моль/л; [HCl]=0,20 моль/л; [O2]=0,32 моль/л. Вычислите исходные концентрации хлористого водорода и кислорода.
(Ответ: [HCl]исх=0,70 моль/л; [O2]исх=0,39 моль/л).
93. Константа равновесия гомогенной реакции:
CO(г) + H2O(г) ⇄CO2(г) + H2(г)
при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации C0(CO)=0,10 моль/л; C0(H2O)=0,40 моль/л.
(Ответ: [CO2]=[H2]=0,08 моль/л; [CO]=0,02 моль/л; [H2O]=0,32 моль/л)
94. Константа равновесия гомогенной реакции:
N2 + 3H2 ⇄ 2NH3
при температуре 400 0С равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,20 моль/л и 0,08 моль/л. Вычислите равновесную и начальную концентрации азота.
(Ответ: 0,80 моль/л; 0,84 моль/л)
95. В гомогенной системе: 2CO +O2 ⇄ 2CO2 при некоторой температуре равновесие установилось при следующих концентрациях реагирующих веществ [CO]=0,20моль/л; [O2]=0,10 моль/л; [CO2]=0,10 моль/л. Вычислите константу равновесия и исходную концентрацию CO и O2.
(Ответ: K=2,5; [CO]=0,30 моль/л; [O2]=0,15 моль/л)
96. Исходные концентрации NO и Cl2 в гомогенной системе: 2NO + Cl2 ⇄ NOCl составляют соответственно 0,50 и 0,20 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. (Ответ: 0,416).
97. Напишите выражение для константы равновесия гомогенной реакции CH4 + CO2 ⇄ 2CO + 2H2. Как следует изменить температуру и давление, чтобы повысить выход водорода? Прямая реакция (образования водорода) эндотермическая.
98. Напишите выражение для константы равновесия гетерогенной системы: C(т.) + H2O(г) ⇄ CO(г) + H2(г). Как следует изменить концентрацию и давление, чтобы сместить равновесие влево?
99. Почему при изменении давления смещается равновесие системы N2 + 3H2 ⇄ 2NH3 и не смещается равновесие системы
N2 + O2 ⇄ 2NO? Напишите выражения для констант равновесия каждой из данных систем.
100. Укажите, в каком направлении смещается равновесие в следующих системах:
1) CO(г) + H2O(г) ⇄ СO2(г) + H2(г) , DH1= -42,7 кДж;
2) 2CO(г) + O2(г) ⇄2СO2(г) , DH2= -569,4 кДж;
3) N2O4(г) ⇄ 2NO2(г), DH3=57,4 кДж?
а) при одновременном увеличении температуры и давления; б) при одновременном уменьшении температуры и повышении давления?