 |
|
Зависимость скорости реакции от температуры
С повышением температуры скорость реакции резко увеличивается. Зависимость скорости реакции от температуры приближенно описывается эмпирическим правилом Вант-Гоффа:
при повышении температуры на каждые 10 скорость реакции увеличивается в 2-4 раза.
Величина, которая показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10°, называется температурным коэффициентом скорости реакции γ .
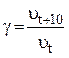 . (4)
. (4)
Поскольку при концентрациях реагирующих веществ I моль/л скорость химической реакции численно равна константе скорости k, то
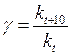 . (5)
. (5)
Определив γ, можно приближенно рассчитать скорость (константу
скорости) реакции при любой температуре:
 (6) или
(6) или  (7)
(7)
Правило Вант-Гоффа применяется для ориентировочных расчётов. Более точно зависимость скорости (константы скорости) реакции от температуры описывается уравнением Аррениуса:
 , (8)
, (8)
где Еа – энергия активации реакции; R – универсальная газовая постоянная, R=8,314 Дж/моль∙К; Т – температура, К; A –предэкспоненциальный множитель (коэффициент Аррениуса).
Энергия активации – это минимальная энергия взаимодействующих частиц, уровень которой достаточен для того, чтобы все частицы вступили в химическую реакцию. Энергия активации реакции характеризует энергетический барьер, преодоление которого реагирующими частицами приводит к образованию конечных веществ. Энергия активации процесса зависит только от природы реагирующих веществ. Значения энергии активации для химических реакций могут составлять от 40 до 200 кДж/моль.
Предэкспоненциальный множитель А равен произведению стерического фактора Р на общее число соударений молекул Z реагирующих веществ в единице объема за единицу времени.
А = Р · Z
Стерический фактор учитывает число благоприятных способов ориентации молекул по отношению к общему числу способов их возможной взаимной ориентации. Значения Р обычно лежат в пределах от 10-9 до 1.
Из уравнения (8) следует, что при Еа=0 k=A. Предэкспоненциальный множитель можно рассматривать как зкстраполяционное значение константы скорости реакции, когда все молекулы реакционноспособны, т.е. все их соударения эффективны. В реальных условиях, когда Еа > 0, не все соударения являются эффективными. Более того, их доля от общего числа соударений, как правило, незначительна. Доля эффективных соударений определяется экспоненциальным множителем  .
.
Энергия активации легко рассчитывается по уравнению Аррениуса, если известны значения констант скоростей при разных температурах k1 и k2.

Прологарифмируем левую и правую части полученного уравнения:

Если  T = 10 К, то
T = 10 К, то
