 |
|
І. Теоретичні відомості
Експериментальне дослідження спектрів випромінювання різних розріджених газів (тобто спектрів випромінювання атомів) виявили лінійчаті спектри, для яких справджуються певні закономірності.
Для водню було виявлено, що спектри випромінювання в енергетичному діапазоні розміщуються серіями ліній, котрі відносяться до однієї серії і зв’язані між собою функціональними залежностями.
Для видимої частини спектру випромінювання водню Бальмер виявив серію ліній (серію Бальмера), частота яких виражається емпіричною формулою:
 , (1)
, (1)
де n =3, 4, 5, 6... ; R=3,28  – стала Рідберга.
– стала Рідберга.
В спектрі водню знаходиться ще декілька серій, зокрема серія Лаймана в ультрафіолетовій частині спектру і серія Пашена в інфрачервоній частині спектру (рис. 4.2). Серія Лаймана описується формулою:
 , (2)
, (2)
де n = 2, 3, 4; а серія Пашена – формулою:
 , (3)
, (3)
де n = 4, 5, 6.
Серії Бальмера, Лаймана і Пашена схематично зображені на рис.1.
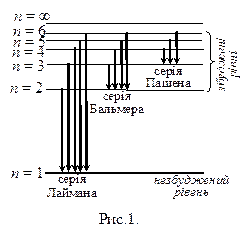 Лінійчатий характер спектрів випромінювання (і поглинання) атомів вказує на те, що атом може випромінювати (і поглинати) енергію тільки певними порціями – квантами. Тобто, звідси слідує, що атом може знаходитися лише в певних дискретних енергетичних станах. Переходячи з одного стану в інший, він випромінює або поглинає квант енергії, який дорівнює різниці енергій початкового і кінцевого станів (до випромінювання і після цього).
Лінійчатий характер спектрів випромінювання (і поглинання) атомів вказує на те, що атом може випромінювати (і поглинати) енергію тільки певними порціями – квантами. Тобто, звідси слідує, що атом може знаходитися лише в певних дискретних енергетичних станах. Переходячи з одного стану в інший, він випромінює або поглинає квант енергії, який дорівнює різниці енергій початкового і кінцевого станів (до випромінювання і після цього).
Виходячи з уявлень про дискретність енергетичних станів атома Н. Бор (1913 р. датський фізик) створив квантову теорію будови атома. В основу поклав три постулати (постулати Бора):
1. Електрони можуть рухатись в атомі тільки по орбітах цілком певного радіуса. Момент кількості руху електрона на цих орбітах кратний величині  :
:
 , (4)
, (4)
де m – маса електрона, v – швидкість електрона, r – радіус орбіти, n – головне квантове число (n – 1, 2, 3...), h – стала Планка.
2. Рух електронів на стаціонарних орбітах не супроводжується випромінюванням (поглинанням) енергії.
3. Перехід електрона з однієї стаціонарної орбіти на іншу супроводжується випромінюванням (або поглинанням кванта енергії).
Величина цього кванта hv дорівнює різниці енергії (W1 і W2) стаціонарних станів атома до і після випромінювання (поглинання):
hv = W1 - W2 . (5)
Умову (4) називають умовою квантування радіуса орбіт, а умову (5) – умовою частот.
Отже частота електромагнітних хвиль, які випромінюються атомом, визначається не частотою обертання електрона навколо атома, а різницею енергій стаціонарних станів атома.
Таким чином, постулати Бора суттєво доповнили модель Резерфорда, позбавивши її від протиріч з експериментом щодо стійкості атомів.
Спектр водню і будова атома водню.
Енергетичні рівні в атомі водню.
В атомі водню навколо ядра (протона) рухається один електрон. Враховуючи суттєво більшу масу протона відносно маси електрона (в 1840 раз), можна допустити, що ядро є нерухомим, а орбіти електрона – кругові. На електрон, що обертається навколо протона, діє дві сили: доцентрова і кулонівська, які себе взаємно зрівноважують. Тобто:
 , (6)
, (6)
де  Ф/м. Розв’язуючи рівняння 6) і (4), отримаємо:
Ф/м. Розв’язуючи рівняння 6) і (4), отримаємо:
 , (7)
, (7)
Використовуючи вираз (7), можна розрахувати радіус будь-якої стаціонарної орбіти електрона. Для прикладу радіус першої орбіти  А.
А.
Визначимо повну енергію W електрона в атомі водню. Вона довнює сумі кінетичної енергія  електрона (за його поступального руху на орбіті) і потенціальної енергії Wп (притягання електрона до ядра).
електрона (за його поступального руху на орбіті) і потенціальної енергії Wп (притягання електрона до ядра).
Використавши рівняння (6), отримаємо:
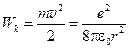 . (8)
. (8)
Потенціальна енергія електрона є від’ємною і чисельно дорівнює:
 . (9)
. (9)
Враховуючи вирази (8) і (9), отримаємо:
 . (10)
. (10)
Підставимо в рівняння (10) вираз для r із формули 7). Отримаємо:
 . (11)
. (11)
За умови переходу електрона з однієї стаціонарної орбіти на іншу (ближчу до ядра), випромінюється квант енергії, який дорівнює різниці енергій енергетичних рівнів атома до випромінювання і після нього.
Самовільного переходу електрона на більш високу орбіту не буває. Для такого переходу необхідно надати атому певну порцію енергії.
Розглянута теорія енергетичних станів атома водню може бути застосована і для водневоподібних атомів, тобто до іонів, в яких на зовнішній орбіті знаходиться один електрон (He, Li+, Be2+).
Квантова теорія Бора дала можливість кількісно пояснити особливості спектрів поглинання та випромінювання атомів водню та іонів водневоподібних атомів, однак не годилася для розрахунку спектрів поглинання та випромінювання багатоелектронних атомів. Подальший розвиток теорії, підвалини якої заклав Н. Бор, привів до створення сучасної квантової механіки, котра може кількісно пояснити особливості будови і властивості різних багатоелектронних атомів і молекул.