 |
|
ДОСЛІДЖЕННЯ АТОМНОГО СПЕКТРА
7.1 Мета роботи
Розрахувати значення енергії електрона в атомі водню і побудувати енергетичну діаграму.
Опанувати експериментальний метод визначення невідомих довжин хвиль у видимій області спектра. Встановити відповідність результатів розрахунків довжини хвиль випромінювання водню за узагальненою формулою Бальмера з експериментальними даними, що одержані за допомогою монохроматора.
7.2 Вказівки з організації самостійної роботи студентів
Спектри є характеристикою атомів і молекул. Розрізняють лінійчасті, смугасті і суцільні спектри. Атоми характеризуються лінійчастими спектрами, тобто енергетичний спектр атомів має дискретну структуру. Слід зазначити, що часто енергетичні рівні є виродженими і, крім того, існують правила відбору при переході з одного рівня на інший [1, с. 386-387; 2, c. 338-340].
Борівська теорія атома підтверджується емпірично одержаною узагальненою формулою Бальмера для атома водню:
 , (м-1) (7.1)
, (м-1) (7.1)
де  – стала Рідберга,
– стала Рідберга, 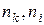 – квантові числа
– квантові числа 
 .
.
У спектрі випромінювання атома водню спостерігаються окремі групи ліній, які мають назву спектральних серій.
Серією називається сукупність спектральних ліній, хвильові числа яких описуються формулою Бальмера, при 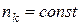 . Кожна серія характеризується головною лінією
. Кожна серія характеризується головною лінією  і границею серії.
і границею серії.
Спектр випромінювання атома водню складається з серій, які подані у табл. 7.1.
Таблиця 7.1 – Спректральні серії атомів
| Серія | Область спектра | Формула серії | Межа серії |
| Лаймана | Ультрафіолетова | 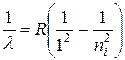 , ,

| 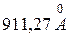
|
| Бальмера | Видима |  , ,

| 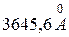
|
| Пашена | Інфрачервона |  , ,
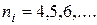
| 
|
| Брекета | Інфрачервона |  , ,

| 
|
| Пфунда | Інфрачервона |  , ,

| 
|
Фізичний зміст формула Бальмера отримала внаслідок створення Шредінгером квантовомеханічної теорії атома водню. Кожній мікрочастинці зіставляється хвильова функція, яка характеризує її стан і знаходиться з роз’язання рівняння Шредінгера. Для електрона атома водню рівняння Шредінгера розв’язується при дискретних негативних значеннях повної енергії:
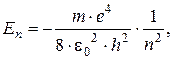
 , (Дж) (7.2)
, (Дж) (7.2)
де 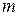 – маса електрона,
– маса електрона,  – заряд електрона,
– заряд електрона,  – електрична стала,
– електрична стала,
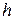 – стала Планка,
– стала Планка,  – головне квантове число. Тобто атом водню може мати тільки квантовані значення енергії. Схема рівнів енергії зображена на рис. 7.1, а.
– головне квантове число. Тобто атом водню може мати тільки квантовані значення енергії. Схема рівнів енергії зображена на рис. 7.1, а.

Рисунок 7.1 – Спектральні серії атомів
Згідно з постулатами Бора, випромінювання кванта світла можливе при переході електрона з початкового стану з головним квантовим числом  і енергією
і енергією  у нижчий стан з
у нижчий стан з  і енергією
і енергією  . Частота фотона, який випромінюється (з урахуванням (7.2)):
. Частота фотона, який випромінюється (з урахуванням (7.2)):
 . (7.3)
. (7.3)
Порівнюючи (7.3) з (7.1), одержимо сталу Ридберга
 . (7.4)
. (7.4)
Під час вивчення спектра водню за допомогою приладу з високою роздільною здатністю виявилось, що лінії мають тонку структуру (рис. 7.1, б), що пояснюється, якщо взяти до уваги спін-орбітальну взаємодію. На рис. 7.1, б зображена тонка структура головної лінії серії Бальмера.
7.3 Опис лабораторної установки
Схема установки для дослідження спектра водню наведена на рис. 7.2.

Рисунок 7.2 – Схема лабораторної установки
В експериментальній установці випромінювання водню одержують завдяки електричному розряду в газі водню в розрядному приладі 1. Проходячи крізь калібровану щилину 2, промінь потрапляє на дисперсійну призму монохроматора 3, де розкладається в спектр. Повертаючи барабан 4, можна крізь окуляр 5 знайти будь-яку лінію видимого спектра (серія Бальмера) і за допомогою шкали 6 визначити довжину світлової хвилі, що віповідає цій лінії, у нанометрах.
7.4 Порядок виконання роботи і методичні вказівки з її виконання
1. Увімкнути лабораторну установку та прогріти 3 хвилини. Використовуючи шкалу 6, визначити довжину хвиль усіх ліній серії Бальмера.
2. Використовуючи формулу (7.4), розрахувати сталу Рідберга.
3. Розрахувати довжини хвиль серії Бальмера, виходячи з формули:  .
.
4. Аналізуючи дані п.1 та п.3, визначити відповідність.
5. Використовуючи формулу (4.2), обчислити значення енергії електрона для  і
і  .
.
6. Побудувати в масштабі рівні енергії з зазначенням головного квантового числа (енергетичну діаграму). Енергію розрахувати у джоулях і електронвольтах.
7. Визначити з енергетичної діаграми енергію фотонів і їх довжини хвиль для серії Бальмера. Порівняти їх з результатами, одержаними в п. 2.
7.5 Контрольні запитання і завдання
1. Які серіальні закономірності спостерігаються у спектрі атомарного водню?
2. Чим спектр атомарного водню відрізнятиметься від спектра молекулярного водню?
3. Що таке спектральна серія?
4. Якою формулою описується серія Бальмера?
5. Що таке енергія іонізації атома? Енергія збудження?
6. Поясніть зміст від’ємного значення енергії електрона в атомі.
7. Які ви знаєте квантові числа, який їх фізичний зміст?
8. Які стани називають виродженими? Які виродження можна зняти?
9. Чим обумовлена тонка структура ліній у спектрі водню?
10. Які види спектрів ви знаєте, і в яких випадках кожен з них спостерігається?
11. Сформулюйте постулати Бора.
12. Які правила відбору виконуються при переходах атомів з одних енергетичних рівнів на інші?