 |
|
Примеры названий природных биоорганических соединений
Таблица 2
| Тривиальное название, формула | Систематическое название | Правила составления названий |
β- оксимасляная кислота (образуется в печени при недостатке углеводов
в питании, при
инсулинзависимом диабете)
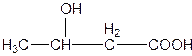
| 3- гидроксибутановая кислота | Корень- бутан Суффикс - овая кислота Префикс - гидрокси |
Пировиноградная кислота-
образуется во всех клетках человека, животных, растений, многих микроорганизмов.

| 2-оксопропановая кислота | Корень – пропан. Старшая группа СООН, класс карбоновых кислот, суффикс - овая кислота. Начало нумерации - атом углерода карбоксильной группы. Заместитель группа С = О, в положении 2, префикс оксо. |
| Коламин(природное вещество, образуется в организме, нужен для синтеза медиатора ацетилхолина) HO- СН2- СН2 – NH2 | 2-аминоэтанол-1 | Корень – этан Старшая группа ОН–определяет класс (суффикс - ол). Младшая группа NH2- префикс – амино. Нумерация цепи от старшей группы |
| Меркамин ( лекарственный препарат) HS- СН2- СН2 – NH2 | 2-аминоэтантиол-1 | Корень – этан Старшая группа НS–определяет класс (суффикс -тиол) Младшая группа NH2 – префикс – амино. Нумерация цепи от старшей группы |
Глицерин - природное вещество. Образуется в организме, участвует
в синтезе липидов (жиров)

| Пропантриол-1, 2, 3 | Корень пропан. Класс - спирт, старшей группе ОН соответствует суффикс – ол. Места расположения групп – 1, 2, 3 , количество групп - три |
Изопрен – структурная
единица многих природных веществ (каротина)

| 2-метилбутадиен-1,3 | Корень – бута(н) Класс алкен, суффикс – ен. Количество двойных связей две – ди. Места расположения связей- 1, 3. Метильная группа в положении -2. |
| Аланин – природная аминокислота, входит в состав белков СН3 —СН—СООН | NH2 | 2-аминопропановая кислота | Корень – пропан. Старшая группа СООН, класс карбоновых кислот, суффикс - овая кислота. Начало нумерации - атом углерода карбоксильной группы. Младшая группа NH2- префикс - амино Нумерация цепи от старшей группы |
Раздел 2. Сопряженные системы.
Исходный уровень знаний для усвоения темы основан на школьной программе органической химии и разделе 1 данного пособия:
Электронные конфигурации элементов в невозбужденном состоянии (углерод, кислород, азот, водород, сера, галогены), понятие «орбиталь», гибридизация орбиталей атома углерода, азота, пространственная ориентация орбиталей (sp3 , sp2) , ковалентные σ -и π – связи, изменение электроотрицательности элементов в периоде и группе, классификация, номенклатура органических соединений.
Для усвоения темы и приобретения компетенции по данному разделу надо знать:
- определение и виды сопряжения и сопряженных систем (ациклические, ароматические),
- условия делокализации, ароматичности,
- формулы соединений – антрацен, бензол, бутадиен, изопрен, имидазол, индол, нафталин, пиридин, пиримидин, пиррол, пурин, тиофен, фенантрен, фуран,
- формулу Хюккеля, правило подсчета числа π - электронов в ароматическом соединении,
- особенности образования ароматических систем в шестичленных и пятичленных гетероциклических соединениях.
Ключевые слова.
Ароматическое соединение. Ароматичность. Ароматический секстет. Гетероциклическое соединение. Гибридная( гибридизованная) орбиталь Делокализация. Карбоциклическое соединение . Ковалентная связь. Кратная связь. Неподеленная пара электронов. Пиримидиновый атом азота. Пиррольный атом азота. Правило Хюккеля. Полярная связь. Сопряжение( конъюгация). Сопряженная система. Цепь сопряжения. Циклическая сопряженная система. Циклы π–избыточные,π– недостаточные (дефицитные). Энергия сопряжения. Энергия делокализации( энергия резонанса).
Содержание раздела 2 (Дидактические единицы)
2.1.Классификация сопряженных соединений (ациклические, циклические). Определение- сопряжение. Виды сопряжения( π, π- π,р- сопряжение). Делокализация. Энергия делокализации (сопряжения).
2.2. Ациклические сопряженные системы: бутадиен-1,3, метилбутадиен-1,3 ( изопрен), пропеновая, кротоновая, фумаровая кислоты.
2.3. Циклические сопряженные системы- ароматические( карбоциклические и гетероциклические). Критерии (условия ароматичности). Правило Хюккеля.
2.3.1. Карбоциклические: бензол, нафталин, антрацен, фенантрен.
2.3.2. Гетероциклические: пятичленные — фуран, тиофен, пиррол, имидазол, шестичленные – пиридин, пиримидин, многочленные – индол,
пурин.
Нумерация атомов в пиридине, пиримидине, пурине.
Механизм образования ароматической системы в пятичленных и шестичленных гетероциклах. Отличие основных свойств «пиррольного и пиридинового» атомов азота. Понятия : π- избыточные (пятичленные), π-недостаточные (шестичленные) гетероароматические соединения.
Сохранение ароматического секстета в пиридиниевом катионе.
Приложение. Основы теории.
Органические молекулы образованы посредством ковалентных связей. Ковалентные связи возникают по обменному механизму между двумя атомами за счет общей (обобществленной) пары электронов. Образуются неполярные и полярные связи. Полярные связи характеризуются несимметричным (неравномерным) распределением электронной плотности, происходит ее смещение в сторону более электроотрицательного атома. Ковалентные связи могут быть двух типов: сигма (σ) и пи (π). σ - Связи участвуют в образовании скелета молекулы, они являются главными , а π -связи можно рассматривать как дополнительные, но придающие молекулам особые химические свойства. (рис. 1)

Рис.1 Виды химических связей и механизм их образования
Среди природных биоорганических веществ большое место занимают соединения, которые относят к сопряженным системам.
Сопряженными (конъюгированными) называют кратные связи( двойные или тройные), разделенные одинарной связью.
..-С=С-С=С-С=С-С=С-…
|_______________|
цепь сопряжения
Чередующиеся кратные и простые связи образуют цепь сопряжения.
Чередование кратной связи с атомами, имеющими неподеленные пары электронов (кислород, азот, сера, галогены) также создает сопряженную систему.
… С= С – NH – C= C – С – С =С-
|_______________|
цепь сопряжения
Различают два вида сопряженных систем: ациклические (цепь сопряжения разомкнута) , циклические (цепь сопряжения замкнута).
Сопряженные соединения (π – π, π – р )
 |  | ||
ациклические циклические
 |  | ||
карбоциклические гетероциклические
К ациклическим молекулам с сопряженными связями относятся бутадиен-1,3, метилбутадиен-1,3 (изопрен), каротин (пигмент моркови и красного перца), витамин А формах ретинола и ретиналя, ликопин (пигмент помидора), биологически активные карбоновые кислоты, занимающие видное место в процессе обмена веществ: пировиноградная, фумаровая, кротоновая. На участке сопряжения возможно взаимодействие негибридных р-электронов, возникает делокализованная связь.
| Делокализованная связь-это ковалентная связь, в которой π – электронная плотность не локализована между двумя соседними р - орбиталями, а распределяется по всей π - орбитальной системе. Только сопряжение создает возможность делокализации |
Циклические сопряженные системы бывают двух видов: карбоциклические и гетероциклические
Карбоциклические – скелет молекулы образован только атомами углерода, возникает π - π - сопряжение. Гетероциклические - скелет молекулы образован атомами углерода и гетероатомами (азот, кислород, сера), в этих соединениях возникают два вида взаимодействия:: π , π и π , р - сопряжение.
Особое место среди циклических сопряженных соединений занимают так называемые ароматические. Их особые химические свойства:
1. устойчивость к действию окислителя перманганата калия в растворе,
2. устойчивость, несмотря на высокую степень ненасыщенности, к действию раствора брома, что означает неспособность к реакциям присоединения в условиях, типичных для алкенов и полиенов,
3. способность к реакциям замещения в растворе по ионному
(катионному, электрофильному) механизму. Перечисленный комплекс химических свойств стали называть ароматическими свойствами, а вещества, обладающими этими свойствами - ароматическими. Классическим примером является бензол.
Рентгеноструктурный анализ кристаллов бензола обнаружил, что молекула бензола
• имеет плоское ( планарное) строение
• правильный шестичленный цикл
|• углы между всеми связями равны 120
• длина всех связей С-С одинаковая , равна 1,39А и имеет среднее значение между длиной одинарной связи 1,54А и длиной двойной связи 1,34 .
Эти научные данные следует объяснить образованием общей электронной системы, состоящей из 6 электронов (ароматический секстет). Электронная плотность равномерно распределена между атомами углерода, которые находятся в sp2-гибридном состоянии. Максимум электронной плотности негибридизованных р-орбиталей находится над и под плоскостью бензольного кольца. (рис 2 )

 s-скелет лежит в плоскости
s-скелет лежит в плоскости
Рис. 2 Схема расположения негибридизованных р-орбиталей в бензоле и расположения атомов углерода в скелете
Образование общей π-электронной системы в бензоле относится к явлению делокализации. Устойчивость бензола за счет делокализации электронов повышается на 36,6 ккал\моль (150 кдж\моль). Эта величина носит название - энергия делокализации (энергия резонанса). Возникает повышенная термодинамическая устойчивость. Повышенной термодинамической устойчивостью, а следовательно, и ароматическими свойствами обладают только те циклические соединения, которые имеют
• плоское строение
• сопряженную систему связей
•число π -электронов в сопряженной системе N(π ) = 4n+2 , где n - целое число 1,2,3.4 и т. д., получаются значения N= 6, 10, 14, 18 и т. д.
Формула N(π ) = 4n+2 носит название « правило Хюккеля».
Природные шестичленные гетероциклические ароматические соединения содержат один или несколько атомов азота. В пиридине присутствует один атом азота, а в пиримидине два атома в положении 1,3 относительно друг друга. Атомы азота в шестичленных азотсодержащих гетероциклических соединениях сохраняют основные свойства (более слабые по сравнению с аммиаком). В молекуле пиридина один основный атом азота, а в пиримидине - два основных атома азота. Образование соли не нарушает ароматическую систему, но усиливает неравномерное распределение электронной плотности. Шестичленные гетероциклы относятся к «π - недостаточным циклам».
Пятичленные ароматические гетероциклические соединения образованы с участием атомов азота, кислорода, серы. Имеется доказательство включения пары электронов гетероатома в ароматический секстет: пиррол не проявляет основных свойств, в обычных условиях не взаимодействует с кислотами и не образует с ними солей. Пиррол, фуран, тиофен относятся к «π -избыточным циклам», т.к. 6 электронов в ароматической системе распределены между 5 атомами, составляющими эту систему.
Производными пиридина являются никотиновая кислота, никотинамид
(витамин РР), который входит в состав переносчика электронов кофермента NAD+ , витамин В6, регулирующий обмен аминокислот и синтез гема. На основе пиридина получены противотуберкулезные препараты (изониазид)
В организме человека пиримидин представлен тремя главными представителями - урацилом, тимином и цитозином, которые входят в состав нуклеиновых кислот и носят название «пиримидиновые азотистые основания» нуклеиновых кислот.
Пиррол содержится в составе гема - сложной четырехпиррольной ароматической порфириновой системы, включающей в себя ионы металлов. Сопряженная система гема гемоглобина содержит 30 π -электронов (соответствует правилу Хюккеля)
Производные пурина - аденин и гуанин входят в состав нуклеиновых кислот (пуриновые азотистые основания), самое распространенное в организме человека макроэргическое соединение АТФ также содержит аденин.
(PS . Структурные химические формулы названных химических соединений можно найти в разделе «Формулы химических соединений»).
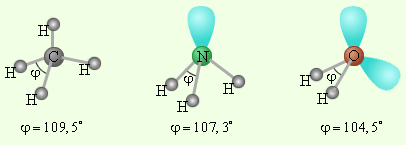
СН4 NН3 Н2О
Рис. 3. Пространственное расположение валентных орбиталей атомов углерода (СН4) , азота(NН3), кислорода (Н2О) в гибридизованном состоянии sp3.
Обучающая задача 1.
Соединение нафталин обладает неприятным характерным запахом, нерастворимо в воде и растворимо в органических растворителях (бензоле). Многие его соединения токсичны для организма, обладают канцерогенной активностью, но его природное витамин К необходим для нормального функционирования свертывающей системы крови и синтеза костной ткани (остеогенеза). Можно ли считать нафталин ароматическим соединением?
Какие нужны сведения для доказательства?
Решение.
1. Необходимо знать химический состав нафталина. Брутто-формула нафталина С10Н8.
2. Следует обсудить его состав и некоторые известные химические свойства. Нафталин, судя по брутто-формуле, ненасыщенное соединение. О химических свойствах можно прочитать, что он не обесцвечивает раствор бромной воды и перманганата калия. Эти качества характерны для ненасыщенных соединениях, которые относятся к ароматическим.
3. Если составлять структурную химическую формулу, то состав С10Н8 позволяет предложить бициклическое конденсированное соединение с сопряженной системой связей.
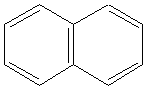
4. Для подтверждения ароматических свойств следует определить общее число π - электронов в сопряженной системе.
Все 10 атомов углерода в соответствии со структурной формулой находятся в sp2 гибридизованной состоянии, и каждый атом отдает в общую систему по одному электрону с негибридизованной орбитали (всего 10 электронов).
4. Применим формулу Хюккеля, чтобы удостовериться, что система ароматическая.
N=4n+2 4 · 2 + 2=10
5. Нафталин - карбоциклическое ароматическое соединение, содержащее два щестичленных конденсированных цикла.