 |
|
Ароматические, гетероароматические кислоты, гидроксикислоты, дикарбоновые кислоты, моно карбоновые кислоты, оксокислоты, стереоизомерия, таутомерия, цикл Кребса.
Содержание раздела (Дидактические единицы)
6.1. Карбоновые кислоты, строение функциональной карбоксильной группы. Диссоциация карбоксильной группы, распределение электронной плотности в карбоксильной группе и карбоксилат-анионе.
6.2. Классификация карбоновых кислот
– по строению радикала (насыщенные, ненасыщенные, карбоароматические,
гетероароматические)
- по числу карбоксильных групп (монокарбоновые, дикарбоновые, трикарбоновые)
-по наличию в радикале иных функциональных групп (гидроксикарбоновые, оксокарбоновые, аминокислоты), число этих групп может быть больше одной, возможно их разнообразное сочетание.
6.3. Химические свойства карбоксильной группы (общие для всех карбоновых кислот RCOOH)
6.3.1. Реакции замещения атома водорода: образование солей при взаимодействии с металлами, оксидами, гидроксидами, солями более слабых кислот (угольной).
6.3.2. Реакции нуклеофильного замещения SN in vivo ( замещение гидроксигруппы в составе функциональной карбоксильной группы) заключаются в образовании сложных эфиров (реакция этерификации), амидов, тиоэфиров (активных форм карбоновых кислот, содержащих макроэргическую связь). Номенклатура эфиров.
6.3.3. Реакция карбоксилирования в а-положение (а- СН-активный кислотный центр)– важнейший синтез новых карбоновых кислот in vivo.
6.4 Гомологический ряд низших насыщенных монокарбоновых кислот
(от муравьиной до валериановой). Физические свойства. Изменение кислотных свойств в гомологическом ряду. Биологическое значение муравьиной, уксусной, бутановой (масляной) кислот, ацетилКоА, эфира валериановой кислоты.
6.5. Непредельные монокарбоновые кислоты: пропеновая (акриловая), метилпропеновая (метакриловая), 3-бутеновая (кротоновая).
Особые химические свойства :
- присоединение воды - гидратация (проходит против правила Марковникова), образование β –гидроксикарбоновых кислот.
- восстановление (гидрирование), получение насыщенных кислот.
6.6. Насыщенные дикарбоновые кислоты (щавелевая, малоновая, янтарная, глутаровая, адипиновая). Физические свойства. Изменение кислотных свойств в гомологическом ряду. Биологическое значение янтарной, малоновой кислот.
Особые химические свойства:
-образование нерастворимой соли щавелевой кислоты - оксалата кальция, патохимическая роль в организме,
- декарбоксилирование щавелевой и малоновой кислот (теоретическое обоснование реакции),
-дегидрирование янтарной кислоты (образование in vitro – фумаровой и малеиновой, in vivo – фумаровой).
6.7. Ненасыщенные дикарбоновые кислоты бутендиовые: цис (малеиновая) и транс (фумаровая). Физические свойства, строение, различие биологических функций (фумаровая кислота образуется в реакциях цикла Кребса, а малеиновая - токсичное для организма соединение и в природе не встречается)
Особые химические свойства:
- реакция гидрирования фумаровой и малеиновой кислот
-реакция гидратации фумаровой кислоты in vivo (стереоспецифическое образование D - или L – яблочных кислот).
6.8. Карбоароматическая кислота бензойная, гетероароматические никотиновая, изоникотиновая.
6.9. Гидроксикарбоновые кислоты: моно, ди, трикарбоновые, физические свойства, биологическое значение. Сравнение кислотных свойств с карбоновыми кислотами.
а. моногидроксикарбоновые: гидроксиуксусная (гликолевая), 2-гидроксипропановая (D и L- молочная, лактат), 3-гидроксибутановая( β-оксимасляная).
б. моногидроксидикарбоновые: 2-гидроксибутандиовая (D и L- яблочная, малат)
в. моногидрокситрикарбоновые: лимонная, изолимонная.
Особые химические свойства гидроксикислот:
- реакция элиминирования (внутримолекулярной дегидратации )
а. 3-гидроксибутановая ↔ кротоновая + НОН
б. яблочная ↔ фумаровая + НОН
в. лимонная —> цис-аконитовая + НОН
- реакции окисления, образование кетокислот
а. молочная + НАД+ —> пировиноградная + НАДН + Н+
б. яблочная + НАД+ —> щавелевоуксусная + НАДН + Н+
в. изолимонная + НАД+ —> а-кетоглутаровая + НАДН + Н+
6.10 Оксо (кето) карбоновые кислоты: монооксомонокарбоновые, монооксодикарбоновые. Сравнение кислотных свойств с гидроксикарбоновыми кислотами.
а. монооксомонокарбоновые: оксоуксусная (глиоксалевая), оксопропановая (пировиноградная), 3-оксобутановая (β- оксомасляная, ацетоуксусная).
б. монооксодикарбоновые кислоты (кислоты цикла Кребса ): 2-оксобутандиовая (щавелевоуксусная), а- кетоглутаровая
Особые химические свойства оксо( кето) кислот:
- стереоспецифическая реакция восстановления in vivo , образование D или L- гидроксикарбоновых кислот.
а. пировиноградная + НАДН + Н+ —> молочная + НАД+
б. щавелевоуксусная + НАДН + Н+ —> яблочная + НАД+
- реакция декарбоксилирования а- и β – оксокислот
а. пировиноградная —> уксусный альдегид + СО2
б. ацетоуксусная —> ацетон + СО2
в. кето-енольная таутомерия оксокислот: пировиноградной, ацетоуксусной, щавелевоуксусной. Строение и биологическая роль фосфорного эфира пировиноградной кислоты (фосфоенолпирувата), макроэргического соединения.
По теме занятия надо уметь составить реакции превращений кислот:
а. молочная кислота —> пировиноградная —> уксусный альдегид
б. янтарная кислота —> фумаровая —> яблочная —>щавелевоуксусная
в. щавелевоуксусная —>яблочная —>фумаровая —> янтарная
г. 3- бутеновая кислота ( кротоновая ) —> β- гидроксимасляная
—>ацетоуксусная —>ацетон
д. лимонная( цитрат) —> цис-аконитовая —> изолимонная
Приложение. Основы теории.
Строение карбоксильной группы и аниона кислоты.
О б- О О
// // /
R – C <===> R – C + Н + R – C (-)
\ \ \
О – Н б + О – О
Карбоновая кислота Карбоксилат – анион Выравнивание
(делокализация)
Реакции замещения атома водорода: образование солей при взаимодействии с металлами, оксидами, гидроксидами, солями более слабых кислот (угольной).
R-COOH + NaOH ——> R-COONa + HOH
R-COOH + Mg(OH )2 ——> (R-COO)2 Mg +2HOH
R-COOH + NaНСO3 ——> R-COONa + СО2 + HOH
Последняя реакция имеет биологическое значении для поддержании рН крови.
Реакции нуклеофильного замещения SN in vivo .
а. Реакция этерификации обратима, в условиях in vitro сложные эфиры получают при взаимодействии органической кислоты и спирта ( нагревание в присутствии серной (фосфорной) кислоты).
сложный эфир
R-COOH + R1-OH ↔ R- C =O + НОН
\
O R1
б. Образование активной формы карбоновой кислоты ацилкоэнзима А в клетке in vivo с участием фермента происходит при одновременном распаде АТФ.
АТФ——>АМФ + пирофосфат
R-COOH + HS- КоА ——————>R-CO ~ S- КоА
АцетилКоА ( активная форма уксусной кислоты - важнейшее соединение организма для обеспечения энергетического и пластического обмена).
Реакция карбоксилирования в а-положение (а- СН-активный кислотный центр )– важнейший путь синтеза новых карбоновых кислот in vivo.

 + О = С =О ——>
+ О = С =О ——> 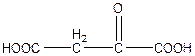
 фермент
фермент
 |
пировиноградная кислота щавелевоуксусная кислота
Гидроксикарбоновые кислоты: Сравнение кислотных свойств с карбоновыми кислотами: гидроксигруппа увеличивает кислотные свойства.
Изменение кислотных свойств можно объяснить на основе передачи индуктивного электронного эффекта в углеродной цепи, введение акцепторных групп увеличивает кислотные свойства.
пропановая < молочная < яблочная
молочная < гликолевая
3-гидроксибутановая < 2-гидроксипропановая
Кислотные свойства кетокислот больше, чем гидроксикислот, поскольку кетоновая группа проявляет больший отрицательный индуктивный эффект.
пировиноградная кислота > молочная кислота
2-оксопропановая > 3-оксобутановая
(пировиноградная ) ( ацетоуксусная)
Пировиноградная кислота образуется в клетках при обмене глюкозы в процессе гликолиза и является веществом, которое используется в анаэробных и аэробных условиях энергетического обмена. Ацетоуксусная кислота образуется в печени и участвует в энергетическом обмене в мышцах.
Гликолевая кислота в настоящее время используется в косметологии для кожных процедур, молочная кислота - конечный продукт обмена глюкозы в анаэробных условиях, β - оксимасляная – образуется в печени и участвует в энергетическом обмене в мышцах.
Превращение ацетоуксусной кислоты в ацетон – патологический процесс, который возникает при накоплении в крови кислоты при инсулинзависимом сахарном диабете или сильном голодании.
| β - Гидроксимасляная и ацетоуксусная кислоты, ацетон носят название кетоновых тел, но ацетон – это патологическое кетоновое тело. |
С образования лимонной кислоты из ацетилКоА и щавелевоуксусной кислоты начинается цикл Кребса (второе название - цитратный цикл) и заканчивается вновь образованием щавелевоуксусной кислоты. Молекула АцКоА разрушается до двух молекул СО2
Последовательность превращений кислот в цикле Кребса:
Щавелевоуксусная кислота + ацетилКоА → Лимонная (цитрат) → изолимонная → кетоглутаровая → янтарная→ фумаровая → яблочная → щавелевоуксусная
Обучающая задача
Биохимики при исследовании энергетического обмена обнаружили, что в эксперименте in vitro при добавлении в митохондрии янтарной кислоты увеличивается образование щавелевоуксусной кислоты. Составить схему возможных реакций.
Решение.
1.Запишем формулы янтарной и щавелевоуксусной кислот. Сравним сходство и отличия в строении.

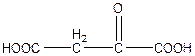
янтарная кислота щавелевоуксусная кислота
Оба соединения относятся к дикарбоновым кислота и содержат одинаковой число атомов углерода. Янтарная кислота - насыщенная, в щавелевоуксусной кислоте есть функциональная кетоновая группа.
2. Составим примерную схему и начнем решать задачу с конца.
Янтарная кислота —— ? ? ? ——> щавелевоуксусная
3. Поставим вопрос: можно ли напрямую янтарную кислоту превратить в оксокислоту? Нет, необходимо иметь предварительно соединение с гидроксигруппой, из которой можно в процессе окисления получить кетогруппу. В данном случае такой кислотой является яблочная.
 + НАД+———>
+ НАД+———> 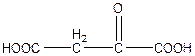 + НАДН + Н+
+ НАДН + Н+
яблочная щавелевоуксусная
4. Подумаем, как из янтарной кислоты получить яблочную? Известен способ синтеза гидроксикислот из непредельных путем гидратации. Такой непредельной дикарбоновой кислотой является бутендиовая (в митохондрии образуется ее транс-изомер фумаровая кислота).
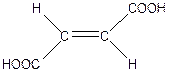 + Н2О ———>
+ Н2О ———> 
фумаровая яблочная
5. Остается последний этап превращения янтарной кислоты в фумаровую. В условиях in vivo проходит реакция дегидрирования. Окислителем, переносчиком водорода, является кофермент ФАД
 + ФАД ———>
+ ФАД ———> 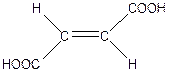 + ФАДН2
+ ФАДН2
Янтарная фумаровая
6. Составим схему с участием всех кислот:
Янтарная——> фумаровая ———> яблочная——> щавелевоуксусная
Можно предположить, что именно так рассуждал известный биохимик Г. Кребс, когда составлял схему химических реакций, зная только двух « участников» открытого им основного цикла энергетического обмена. За свои исследования он был удостоен Нобелевской премии в 1953г.
Формулы химических соединений, изучаемых в разделе 6