 |
|
Раздел 9. Полипептиды. Белки
Исходный уровень знаний для усвоения темы основан на школьной
программе органической химии, программе по биологии «Синтез белка», программе по химии «Протолитическая теория кислот и оснований. Буферные системы», «Физико-химия дисперсных систем. Растворы ВМС», разделах 1, 3 – 6, 8 данного пособия.
Для подтверждения компетентности в данной теме необходимо умение
- составлять структурные формулы первичной структуры трипептида по заданной последовательности аминокислот,
- определять область рI,
- заряд трипептида в растворе при определенном значении рН,
- рН раствора трипептида известного состава (например, ала- асп - фен, сер- лиз- мет, гли- про- вал.)
-определять направление движения трипептида в электрическом поле при различных значениях рН раствора
Ключевые слова
C- концевая аминокислота, N- концевая аминокислота, белок( глобулярный, фибриллярный), денатурация, качественные реакции, пептид, пептидная связь, а – спираль, структура белка (первичная, вторичная, третичная, четвертичная), фермент, электрофорез.
Содержание раздела
9.1. Определения «пептид», «белок»
9.2. Биологические функции пептидов и белков
9.3. Классификация белков : простые и сложные
9.4. Строение пептидов и белков.
9.4.1. Пептиды. Образование пептидной связи in vitro – реакция
нуклеофильного замещения, in vivo - синтез на рибосомах с участием тРНК.
9.4.2. Особенности электронного и пространственного строения:
делокализация электронной плотности, плоскостное транс-строение, наличие NН кислотного центра, таутомерия.
9.4.3. Вторичная структура белка. Строение, параметры а- спирали, стабилизация водородными связями, расположение радикалов аминокислот. Особенности строения β – структуры.
9.4.4.Третичная структура белка. Стабилизация третичной структуры глобулярных белков: ионные, ковалентные, дисперсионные связи. Гидрофильные и гидрофобные участки; роль SH групп пептидов и белков в биологических процессах.
9. 5 . Белки глобулярные и фибриллярные, особенности строения.
9.6. Физико-химические свойства белка: амфотерные свойства, изоэлектрическая точка, способность к диализу, электрофорез белков. Классификация белков на кислые, нейтральные, основные.Изменение заряда белка при изменении значения рН раствора.
9.7.Денатурация белков. Сущность денатурации. Общие факторы денатурации.
9.8. Качественные реакции обнаружения белков в биологических объектах
(биуретовая- обнаружение пептидных связей, ксантопротеиновая- ароматических аминокислот в составе белка)
Приложение. Основы теории.
Биологические функции пептидов
1.Гормональная, адаптивная, регуляторная (окситоцин, рилизинг-факторы гипоталамуса, гипофиза)
2.Нейропептиды мозга (энкефалины, эндорфин)
3.Антиоксиданты (глутатион)
4Алкалоиды растений ( эрготамин)
5.Антибиотики (микробактериальное происхождение- грамицидины, актиномицины)
6.Токсины грибов (бледная поганка), плесени, бактерий, пчел, ос.
Биологические функции белков
1.Каталитическая, регуляторная - ферменты осуществляют контроль направления, катализ и регуляцию скорости биохимических реакций)
2.Двигательная, сократительная (белки мышц актин, миозин, спектрин в мембране эритроцита)
3. Структурная – белки соединительной ткани коллаген, эластин, фибронектин, базальная мембрана
4. Транспортная (гемоглобин, миоглобин, альбумин крови)
5.Регуляторная (гистоны, репрессоры, факторы инициации)
6.Рецепторная (белки- рецепторы эндотелия сосудов, мембран клеток)
7.Гормональная, адаптивная, регуляторная (инсулин, гормон роста, глюкагон)
8.Защитные (иммуноглобулины, интерферон, комплемент, свертывающая и антисвертывающая система крови)
9.8. Антиоксиданты (церулоплазмин )
10. Антибиотики (микробактериальное происхождение- актиноксантин и др.)
11.Запасная (альбумин крови, яиц птиц, глиадин семян растений )
12.Токсины (ботулинический, дифтерийный, столбнячный )
13. Пищевая алиментарная (белки пищи - источники незаменимых аминокислот. Норма белка 70г -100 г/ сутки).
По современным представлениям в строении белка выделяют 4 уровня организации: первичную, вторичную, третичную, четвертичную структуры. Первичная структура - последовательное соединение аминокислот, возникает пептидная связь.
Вторичная структура - термодинамически выгодная организация первичной структуры. Спираль представляет собой наиболее высокоорганизованный и энергетически выгодный тип конформации отдельной полипептидной цепи, состоящей из L- аминокислот. Наиболее устойчивой из всех видов является правовращающая а-спираль, которая была впервые предложена Л. Полингом и Р. Кори в 1950 г. Вторичная структура стабилизируется водородными связями.
Водородные связи образуются между атомом кислорода карбонильной группы и атомом водорода амидной группы, разделенными тремя аминокислотными остатками. Группа NН образует водородную связь с группой С=О четвертого от нее аминокислотного остатка (5 → 1 связь), образуя 13 членный цикл.
Группы, образующие водородные связи, располагаются на соседних витках цепи. Один виток спирали вмещает 3,6 аминокислотных остатка. По всей длине спирали происходит последовательное смещение взаимодействующих группировок. Каждая пептидная группа, начиная со второго витка, образует две водородные связи к предыдущему и последующему виткам. Водородные связи почти параллельны оси спирали, а радикалы размещаются вне спирали на ее наружной поверхности. Спиралевидные участки разных белков обладают одинаковыми параметрами:
-шаг спирали (период идентичности) - 0,54 нм
-радиус спирали -0, 23 нм
В белковых вторичных структурах встречаются отклонения от спирального строения, которые связаны с присутствием пролина, гидроксипролина и валина.
Третичная структура – особым образом пространственно организованная вторичная структура, которая обеспечивает специфические свойства данного белка. В стабилизации третичной структуры участвуют радикалы, расположенные на поверхности глобулы , они создают гидрофильные и гидрофобные участки. На гидрофильных участках возникает ионное взаимодействие (ионизированные карбоксильные группы глу, асп и аминогруппы лиз, арг), водородные связи между гидроксигруппами сер, тре, дисульфидные связи, образованные двумя близко расположенными тиольными группами цис.
Тиольные (меркапто) группы пептидов выполняют функции антиоксидантов, связывают аминокислоты при их транспортировке через мембраны. Тиольная группа НSКоА необходима для образования ацильных активных производных Ацил~SКоА. Тиольные группы белков образуют при окислении дисульфидные связи. Соотношение тиольных и дисульфидных групп – важный фактор стабилизации третичной структуры глобулярного белка.
Гидрофобные участки содержат много радикалов алифатических аминокислот( вал, лей, иле) , бензольные циклы (фен).
При изучении свойств белка обязательно определяют значение изоэлектрической точки Белки, как и аминокислоты, подразделяют на кислые, нейтральные, основные. Если значение рН раствора соответствует значению рI белка ( рН = рI), то суммарный заряд белка равен нулю. Белок заряжен отрицательно при значении рН > рI, белок заряжен положительно при рН < рI. При изменении рН среды изменяется заряд белка, его физико-химические свойства( растворимость, электрофоретическая подвижность)
Если значение рН раствора соответствует значению рI белка ( рН = рI), то суммарный заряд белка равен нулю. Белок заряжен отрицательно при значении рН > рI, белок заряжен положительно при рН < рI.
Неотъемлимым качеством белка является его способность к денатурации.
| Денатурация - потеря природных (нативных) свойств белка. |
Денатурация может быть обратимой и необратимой.
Часто видимым следствием денатурации белка является осаждение белка из раствора.
Общие факторы денатурации:
а) Изменение температуры. Повышение температуры приводит к необратимой денатурации, большинство белков организма человека теряют свою активность при температуре выше 500С, а белки крови - даже при 43 – 450С. На этом основаны стерилизация медицинских препаратов и пастеризация пищевых продуктов. При снижении температуры денатурация является обратимой. Биологический белковый материал можно сохранять долго при низких температурах ( кровь, образцы тканей, растворы белковых гормонов, защитных γ-глобулинов,
стволовые клетки)
б) Изменение рН среды. Вызывает изменение характера ионизации кислотных и основных групп в радикалах, изменяется характер ионного взаимодействия и количество водородных связей - изменяется пространственное строение белка и организация его активных участков. В организме человека поддерживается кислотно-основный гомеостаз. Значение рН крови равное 7,4 обеспечивает необходимую организму биологическую активность всех белковых молекул.
в) Действие окислителей и восстановителей. Изменяется соотношение восстановленных тиольных групп и дисульфидных связей, что вызывает изменение третичной структуры белка.
Лекарственные препараты, обладающие свойствами восстановителей. используются в медицине для поддержания структуры белка (аскорбиновая кислота- витамин С, раствор тиосульфата натрия).
г) Ионы тяжелых металлов (свинца, меди, ртути, цинка) образуют соли с тиольными группами на поверхности белковой молекулы. Попадание в желудочно-кишечный тракт, а затем в кровь ионов тяжелых вызывает тяжелые последствия. В связи с аналогичным токсическим действие свинца запрещено этилирование бензина.
д) Присутствие различных поверхностно-активных веществ, детергентов, которые влияют на гидрофобное взаимодействие в молекуле белка.
е) действие веществ, которые конкурируют за образование водородных связей, например, мочевины. Высокое и низкое содержание мочевины в крови способствует изменению свойств белков кровии внутриклеточных белков, особенно в составе белков мембран нейронов.
е) Действие электролитов разрушает гидратную оболочку белка (процесс «высаливания»).
ж) Физические воздействия (ультразвук, лазерное воздействие, электрокоагуляция). Применяют в косметологии, лечении кожных, стоматологических болезней, в хирургии для остановки кровотечения. В современных медицинских технологиях используют лазерный луч.
В медицине проводят много анализов, связанных с качественным и количественным определением белка. Используют качественные реакции обнаружения белков в биологических объектах: биуретовая- обнаружение пептидных связей, ксантопротеиновая - ароматических аминокислот в составе белка. Биуретовая реакция может быть использована для количественного определения. Для примера: содержание белка в плазме крови равно от 65 до 85 г/л, в слюне менее 5 г/л.
Обучающая задача 1.
Определите заряд трипептида глутатиона γ –глутамил- цистеил-глицина
в водном растворе и среду раствора этого соединения.
Какая химическая особенность возникает при соединении аминокислот в этом пептиде? Глутатион содержится в клетках и биологических жидкостях организма. Он играет заметную роль антиоксиданта (за счет тиольной группы). Участвует в транспорте аминокислот из крови в печень и обезвреживании чужеродных веществ – ксенобиотиков. В лабораторной биохимической диагностике определяют соотношение восстановленной и окисленной форм глутатиона в крови и эритроцитах.
Решение.
1.Запишем формулы аминокислот в перечисленной последовательности.
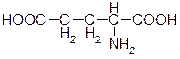


Глу цис гли
2. Определим правила соединения аминокислот при образовании пептидов и бедков.
Первая аминокислота - начало цепи-сохраняет свободную аминогруппу. У последней аминокислоты – конец цепи - сохраняется свободной карбоксильная группа. Соединяются между собой только амино - и карбоксильные группы а - фрагмента. Амино - и карбоксильные группы боковых цепей не участвуют в образовании пептидной цепи.
NH2 - СН- СО - NH - СН- СО - NH - СН- СО- NH - СН- СООН
| | | |
R1 R 2 R3 R 4
начало цепи конец цепи
3. Перейдем к рассмотрению строения глутатиона. Название γ –глутамил- цистеил-глицин указывает, что соединение глу и цис между собой отличается от принятого в пептидах (соединение за счет γ -карбоксильной группы радикала).
γ –глутамат цистеин глицин
NH2 – СН- СН2 –CH2 –СО - NH - СН- СО - NH - СН2- СООН
| |
СООН SH
глутатион (γ –глутамил- цистеил-глицин)
Остальные две аминокислоты цис и гли присоединяются в соответствии с принятой нормой образования полипептидой цепи.
4. Для сравнения составим формулу трипептида глу-цис-гли, в котором аминокислоты соединяются так, как обычно в пептидах и белках.
γ –глутамат цистеин глицин
NH2 – СН-–СО - NH - СН- СО - NH - СН2- СООН
| |
СН2 SH
|
CH2 СООН трипептид глу-цис-гли
Изменился порядок соединения, т.е. первичная структура, но осталось неизменным количество свободных карбоксильных и аминогрупп.
5. Чтобы узнать заряд глутатиона и среду раствора, определим количество
групп, склонных к ионизации. Тиольная группа ионизируется только в щелочной среде. Две карбоксильные группы при диссоциации приобретают заряы (-), и выделяют в раствор два протона (2Н+), а аминогуппа присоедияет протон и превращается в положительно заряженнуюю группу NH3(+). Суммарный заряд глутатиона (-1), среда раствора кислая.