 |
|
Отже, ми маємо два різновиди спектрів: лінійчасті і суцільні. Гармонійні лінійчасті спектри належать періодичним функціям, суцільні – неперіодичним.
Зміст
Вступ. 3
Механізм випромінювання. 4
Види випромінювання. 5
Поняття про спектри. 7
Види спектрів. 9
Перший спектральний аналіз. 12
Спектральний аналіз. 13
Типи спектральних аналізів. 15
Методи реєстрації спектрів. 17
Алгоритм проведення спектрального аналізу. 17
Спектральні апарати. 18
Застосування спектрального аналізу. 19
Висновки. 21
Список використаної літератури. 22
Вступ
Спектр - це розкладання світла на складові частини, промені різних кольорів. Метод дослідження хімічного складу різних речовин по їх лінійчатих спектрах випускання або поглинання називають спектральним аналізом. Для спектрального аналізу потрібно зовсім незначну кількість речовини.
Швидкість і чутливість зробили цей метод незамінним, як в лабораторіях, так і в астрофізиці. Тому що кожен хімічний елемент таблиці Менделєєва випромінює характерний тільки для нього лінійчатий спектр випускання і поглинання, то це дає можливість досліджувати хімічний склад речовини.
Вперше його спробували зробити фізики Кірхгоф і Бунзен в 1859 році, спорудивши спектроскоп.
Механізм випромінювання
Джерело світла має споживати енергію.
Світло - це електромагнітні хвилі з довжиною хвилі 4 * 10-7 - 8 * 10-7 м. Електромагнітні хвилі випромінюються при прискореному русі заряджених частинок. Ці заряджені частинки входять до складу атомів. Але, не знаючи, як влаштований атом, нічого достовірного про механізми випромінювання сказати не можна. Ясно лише, що всередині атома немає світла так само, як у струни рояля немає звуку. Подібно струні, що починає звучати лише після удару молоточка, атоми народжують світло тільки після їх порушення.
Для того щоб атом почав випромінювати, йому необхідно передати енергію. Випромінюючи, атом втрачає отриману енергію, і для безперервного світіння речовини необхідний приплив енергії до його атомів ззовні.
Теплове випромінювання. Найбільш простий і розповсюджений вид випромінювання.
Види випромінювання
-Теплове випромінювання, при якому втрати атомами енергії на випромінювання світла компенсуються за рахунок енергії теплового руху атомів (молекул) випромінюючого тіла. Чим вища температура тіла, тим швидше рухаються атоми. Під час зіткнення швидких атомів (молекул) один з одним частина їх кінетичної енергії перетворюється на енергію збудження атомів, які потім випромінюють світло. Тепловим джерелом випромінювання є Сонце, а також звичайна лампа розжарювання. Лампа дуже зручний, але мало економічне джерело. Лише приблизно 12% всієї енергії, що виділяється в лампі електричним струмом, перетвориться в енергію світла. Тепловим джерелом світла є полум'я. Крупинки сажі розжарюється за рахунок енергії, що виділяється при згорянні палива, і випромінюють світло.
-Електролюмінесценція. Енергія, необхідна атомів для випромінювання світла,може запозичити і з нетеплових джерел. При розряді в газах електричне поле повідомляє електронам велику кінетичну енергію. Швидкі електрони зазнають зіткнення з атомами. Частина кінетичної енергії електронів йде на збудження атомів. Збуджені атоми віддають енергію у вигляді світлових хвиль. Завдяки цьому розряд в газі супроводжується світінням. Це і є електролюмінесценція.
-Катодолюмінесценція. Світіння твердих тіл, викликане бомбардуваннямїх електронами, називають катодолюмінісенцією. Завдяки катодолюмінесценціі світяться екрани електронно-променевих трубок телевізорів.
-Хемілюмінесценція. При деяких хімічних реакціях, що йдуть з виділенням енергії, частина цієї енергії витрачається безпосередньо на випромінювання світла. Джерело світла залишається холодним (він має температуру навколишнього середовища). Це явище називається хеміолюмінесценкією.
-Фотолюмінесценція. Падаюче на речовину світло частково відбивається, а частково поглинається. Енергія поглинається світлом в більшості випадків викликає лише нагрівання тел. Однак деякі тіла самі починають світитися безпосередньо під дією падаючого на нього випромінювання. Це і є фотолюмінесценція. Світло збуджує атоми речовини (збільшує їх внутрішню енергію), після цього вони висвічуються самі. Наприклад,світяться фарби, якими покривають багато ялинкових іграшок, випромінюють світло після їх опромінення. Світло що випромінюється при фотолюмінесценції має, як правило, більшу довжину хвилі, ніж світло, збудженого світіння. Це можна спостерігати експериментально. Якщо направити на посудину з флюоресцеітом (органічний барвник) світловий пучок, пропущений через фіолетовий світлофільтр, то ця рідина починає світитися зелено - жовтим світлом, тобто світлом більшої довжини хвилі, ніж ультрафіолетового світла. Явище фотолюмінесценції широко використовується в лампах денного світла. Радянський фізик С. І. Вавилов запропонував покривати внутрішню поверхню розрядної трубки речовинами, здатними яскраво світитися під дією коротко хвильового випромінювання газового розряду. Лампи денного світла приблизно в три-чотири рази економічніші звичайних ламп розжарювання.
Поняття про спектри
Відповідно формули ряду Фур'є маємо:
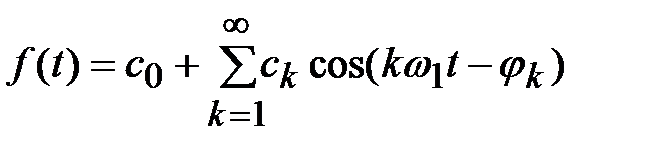 (1)
(1)
Тут  – основна частота. Як бачимо, складна періодична функція
– основна частота. Як бачимо, складна періодична функція  цілком визначається сукупністю величин
цілком визначається сукупністю величин  і
і  . Сукупність величин
. Сукупність величин  зветься спектром амплітуд. Сукупність величин
зветься спектром амплітуд. Сукупність величин  називається відповідно спектром фаз. Для багатьох застосувань досить знати спектр амплітуд; він застосовується настільки часто, що коли говорять про спектр, то мається на увазі саме амплітудний спектр. В інших випадках роблять відповідні застереження. Ми робитимемо так само.
називається відповідно спектром фаз. Для багатьох застосувань досить знати спектр амплітуд; він застосовується настільки часто, що коли говорять про спектр, то мається на увазі саме амплітудний спектр. В інших випадках роблять відповідні застереження. Ми робитимемо так само.
У результаті спектр періодичної функції – дискретний спектр; його називають також лінійчастим, запозичивши цей термін з оптики.
Друга властивість спектра, полягає в тому, що спектр – гармонійний. Це означає, що він складається з рівновіддалених спектральних ліній; частоти гармонік знаходяться в простих кратних співвідношеннях. Зазвичай окремі гармоніки, іноді навіть перша, можуть бути відсутніми, тобто амплітуди їх можуть дорівнювати нулю; це, однак, не порушує гармонійності спектра.
Не слід вважати, що тільки періодична функція має дискретний спектр. Припустимо, наприклад, що складне коливання є результатом додавання двох синусоїдальних коливань з непорівнянними частотами, скажімо, 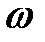 та
та  . Це коливання свідомо неперіодичне, однак спектр його дискретний і складається з двох спектральних ліній.
. Це коливання свідомо неперіодичне, однак спектр його дискретний і складається з двох спектральних ліній.
Функція, що володіє дискретним спектром з довільно розташованими за частотою спектральними лініями, називається майже періодичною.
Отже, дискретні чи лінійчасті спектри можуть належати як до періодичних, так і до неперіодичних функцій. У першому випадку лінійчастий спектр обов'язково гармонійний.
Звернемося тепер до спектрів неперіодичних функцій. Ми вже знаємо, що в результаті граничного переходу від ряду до інтеграла Фур'є інтервали між окремими лініями необмежено скорочуються, лінії зливаються, і замість дискретних точок спектр має зображуватися безперервною послідовністю точок, тобто безперервною кривою. Такого роду спектр називається суцільним.
Отже, ми маємо два різновиди спектрів: лінійчасті і суцільні. Гармонійні лінійчасті спектри належать періодичним функціям, суцільні – неперіодичним.
Види спектрів
Спектральний склад випромінювання речовин дуже різноманітний. Але, незважаючи на це, всі спектри, як показує досвід, можна розділити на кілька типів: існують безперервні, лінійчаті і смугасті спектри випромінювання та стільки ж видів спектрів поглинання.
-Безперервні (суцільні ) спектри. Сонячний спектр або спектр дугового ліхтаря є безперервним. Це означає, що в спектрі представлені хвилі всіх довжин. У спектрі немає розривів, і на екрані спектрографа можна бачити різнокольорову суцільну смугу.

 Розподіл енергії по частотах, тобто спектральна щільність інтенсивності випромінювання, для різних тіл по-різному. Наприклад, тіло з дуже чорною поверхнею випромінює електромагнітні хвилі всіх частот, але крива залежності спектральної щільності інтенсивності випромінювання від частоти має максимум при певній частоті. Енергія випромінювання, що припадає на дуже малі і дуже великі частоти, мізерно мала. При підвищенні температури максимум спектральної щільності випромінювання зміщується в бік коротких хвиль. Безперервні (чи суцільний) спектри, як показує досвід, дають тіла, що знаходяться в твердому або рідкому стані, а також сильно стиснуті гази. Для отримання безперервного спектру потрібно нагріти тіло до високої температури. Характер безперервного спектру і сам факт його існування визначаються не тільки властивостями окремих випромінюючих атомів, а й у сильному ступені залежать від взаємодії атомів один з одним. Безперервний спектр дає також високо температурна плазма. Електромагнітні хвилі випромінюються плазмою в основному при зіткненні електронів з іонами.
Розподіл енергії по частотах, тобто спектральна щільність інтенсивності випромінювання, для різних тіл по-різному. Наприклад, тіло з дуже чорною поверхнею випромінює електромагнітні хвилі всіх частот, але крива залежності спектральної щільності інтенсивності випромінювання від частоти має максимум при певній частоті. Енергія випромінювання, що припадає на дуже малі і дуже великі частоти, мізерно мала. При підвищенні температури максимум спектральної щільності випромінювання зміщується в бік коротких хвиль. Безперервні (чи суцільний) спектри, як показує досвід, дають тіла, що знаходяться в твердому або рідкому стані, а також сильно стиснуті гази. Для отримання безперервного спектру потрібно нагріти тіло до високої температури. Характер безперервного спектру і сам факт його існування визначаються не тільки властивостями окремих випромінюючих атомів, а й у сильному ступені залежать від взаємодії атомів один з одним. Безперервний спектр дає також високо температурна плазма. Електромагнітні хвилі випромінюються плазмою в основному при зіткненні електронів з іонами.
-Лінійчаті спектри. Внесемо в бліде полум'я газового пальника шматочок азбесту, змоченого розчином звичайної кухонної солі. При спостереженні полум'я в спектроскопі на фоні ледь помітного безперервного спектра полум'я, спалахує яскрава жовта лінія. Цю жовту лінію дають пари натрію, які утворюються при розщепленні молекул повареної солі в полум'я. Кожен з них - це система кольорових ліній різної яскравості, розділених широкими темними смугами. Такі спектри називаються лінійчаті. Наявність лінійчатого спектру означає, що речовина випромінює світло тільки цілком певних довжин хвиль (точніше, в певних дуже вузьких спектральних інтервалах). Кожна лінія має кінцеву ширину. Лінійчаті спектри дають всі речовини в газоподібному, атомарному (але немолекулярному) стані. У цьому випадку світло випромінюють атоми, які практично не взаємодіють один з одним. Це самий фундаментальний, основний тип спектрів. Ізольовані атоми випромінюють строго певні довжини хвиль. Зазвичай для спостереження лінійчатих спектрів використовують світіння парів речовини в полум'я або світіння газового розряду в трубці, наповненої досліджуваним газом. При збільшенні щільності атомарного газу окремі спектральні лінії розширюються, і, нарешті, при дуже великому стисненні газу, коли взаємодія атомів стає суттєвим, ці лінії перекривають одинодного, створюючи безперервний спектр.


 Зразковий розподіл спектральної щільності інтенсивності випромінювання у лінійчатому спектрі.
Зразковий розподіл спектральної щільності інтенсивності випромінювання у лінійчатому спектрі.
-Смугасті спектри. Смугастий спектр складається з окремих смуг, розділених темними проміжками. За допомогою дуже хорошого спектрального апарата можна виявити, що кожна смуга являє собою сукупність великого числа дуже тісно розташованих ліній. На відміну від лінійчатих спектрів смугасті спектри створюються не атомами, а молекулами, непов'язаними або слабко пов'язаними один з одним. Для спостереження молекулярних спектрів так само, як і для спостереження лінійчатих спектрів, зазвичай використовують світіння пари в полум'ї або світіння газового розряду.

-Спектри поглинання. Усі речовини, атоми яких знаходяться в збудженому стані, випромінюють світлові хвилі, енергія яких певним чином розподілена по довжинах хвиль. Поглинання світла речовиною також залежить від довжини хвилі. Так, червоне скло пропускає хвилі, що відповідають червоному світлу, і поглинає всі інші. Якщо пропускати біле світло крізь холодний, невипромінюючий газ, то на тлі безперервного спектру джерела з'являються темні лінії. Газ поглинає найбільш інтенсивне світло саме тих довжин хвиль, які він випускає в сильно нагрітому стані. Темні лінії на тлі безперервного спектру – це лінії поглинання, що утворюють в сукупності спектр поглинання.

Лінійчаті спектри відіграють особливо важливу роль, тому що їх структура прямо пов'язана з будовою атома. Адже ці спектри створюються атомами, не відчувають зовнішніх впливів. Тому, знайомлячись з лінійчатими спектрами, ми тим самим робимо перший крок до вивчення будови атомів. Спостерігаючи ці спектри, вчені отримали можливість «зазирнути» всередину атома. Ця наука називається спектральний аналіз.
Перший спектральний аналіз
Вперше спектральний аналіз спробували зробити фізики Кірхгоф і Бунзен в 1859 році, спорудивши спектроскоп.
Світло пропускався в нього через вузьку щілину, прорізану з одного краю підзорної труби (ця труба з щілиною називається коліматор). З коліматора промені падали на призму, накриту скринькою, обклеєні з середини чорним папером. Призма відхиляла у бік промені, які йшли з щілини. Виходив спектр. Після цього завісили вікно шторою і поставили біля щілини коліматора запалений пальник. У полум'я свічки вводили по черзі шматочки різних речовин, і дивилися через другу підзорну трубу на що виходить спектр. Виявлялося, що розпечені пари кожного елемента давали промені строго певного кольору, і призма відхиляла ці промені на строго певне місце, і ні один колір тому не міг замаскувати іншого. Це дозволило зробити висновок, що знайдений радикально новий спосіб хімічного аналізу - за спектром речовини. У 1861 Кірхгоф довів на основі цього відкриття присутність в хромосфері Сонця ряду елементів, поклавши початок астрофізики.
Спектральний аналіз
Спектральний аналіз – фізичний метод аналізу хімічного складу речовини, на основі досліджування спектрів випускання і поглинання атомів чи молекул.
Спектроскопія (спектральний аналіз)— область фізики, використовувана для ідентифікації з'єднань, дослідження складу, будови і кількісного аналізу індивідуальних речовин і багатокомпонентних систем.
Спектри визначаються властивостями електронних оболонок атомів і молекул і коливанням молекул, також різницею маси та структури атомних ядер на положення енергетичних рівнів, також вони залежать від взаємодії атомів і молекул з навколишнім середовищем.
Спектральний аналіз використовує широкий інтервал довжин хвиль – від ренгенівських до мікрорадіохвиль. В спектральний аналіз не входять мас-спектроскопічні методи аналізу, бо не відносяться до області використання електромагнітних хвиль.
Атоми будь-якого хімічного елементу дають спектр, не схожий на спектри всіх інших елементів: вони здатні випромінювати строго певний набір довжин хвиль.

 Видима частина сонячного випромінювання при вивченні за допомогою спектроаналізуючих приладів виявляється неоднорідною – в спектрі спостерігаються лінії поглинання, вперше описані в 1814 році І. Фраунгофером. Спектральний аналіз дозволяє отримати інформацію про склад Сонця, оскільки певний набір спектральних ліній виключно точно характеризує хімічний елемент. Так, за допомогою спостережень спектру Сонця був відкритий гелій. За допомогою спектрального аналізу дізналися, що зірки складаються з тих же самих елементів, які є і на Землі. За допомогою спектрального аналізу можна виявити даний елемент у складі складної речовини. Завдяки універсальності спектральний аналіз є основним методом контролю складу речовини в металургії, машинобудуванні, атомній індустрії.
Видима частина сонячного випромінювання при вивченні за допомогою спектроаналізуючих приладів виявляється неоднорідною – в спектрі спостерігаються лінії поглинання, вперше описані в 1814 році І. Фраунгофером. Спектральний аналіз дозволяє отримати інформацію про склад Сонця, оскільки певний набір спектральних ліній виключно точно характеризує хімічний елемент. Так, за допомогою спостережень спектру Сонця був відкритий гелій. За допомогою спектрального аналізу дізналися, що зірки складаються з тих же самих елементів, які є і на Землі. За допомогою спектрального аналізу можна виявити даний елемент у складі складної речовини. Завдяки універсальності спектральний аналіз є основним методом контролю складу речовини в металургії, машинобудуванні, атомній індустрії.
Інколи замість терміну спектральний аналіз вживається термін спектрохімічний аналіз.
Типи спектральних аналізів
Різні типи спектральних аналізів варто розглядати з трьох точок зору:
1) за розв’язком задачі:
- елементарний, коли визначається склад зразка за елементами;
- ізотропний, коли визначається склад зразка за ізотропами;
- молекулярний, коли визначається молекулярний склад зразка;
- структурний, коли визначаються всі чи основні структурні зв’язки на молекулярному рівні.
2) за методами які використовуються:
- емісійний, використовуються спектри випромінювання, головним чином атомів;
- абсорбаційний, використовуються спектри поглинання, головним чином молекул та їх структуних частин;
- комбінований, використовуються спектри комбінованого розсіювання твердих, рідких і газоподібних зразків, які виникають при попаданні монохроматичного випромінювання;
-люмінісцентний, використовуються спектри люмінісценсії речовини, що виникає через збудження ультрафіолетовим чи катодним випромінюванням;
- рентгенівський, використовуються :
* рентгенівнькі спектри атомів, отриманих при переході внутрішніх електронів в атомах;
* дифракцію рентгенівських променів при переході їх через досліджуваний об’єкт для випромінювання структури речовини.
- радіоспектроскопічний, використовуються спектри поглинання молекул мікрохвильовій зоні спектра з довжинами хвиль більше 1 мм.
3) за характером отриманих результатів:
- якісний, коли в результаті аналізу визначається склад без вказівки на кількісне відношення компонентів, або дається оцінка- мало, дуже мало, багато;
- напівякісний, або грубо якісний (наближений). В цьому випадку результат отримується у вигляді оцінки складу компонентів в деяких інтервалах концентрації в залежності від метода наближення кількісної оцінки;
- кількісний, в результаті якого отримується точний кількісний склад вхідних елементів чи зв’язків у зразку.
Методи реєстрації спектрів:
1. Візуальніпри спостереженні спектрів у видимій області за допомогою простих або спеціалізованих спектроскопів (стілоскоп, стілометр);
2. Фотографічні, використовується фотографічна пластинка чи плівка для реєстрації спектрів з подальшою обробкою;
3. Фотоелектричні для ультрафіолетової, видимої та близької ділянки інфрачервоної областей, використовуються фотоелементи різних типів. Фотоелектричні методи, інколи, називаються методами прямого аналізу, без використання фотоплівки;
4. Термоелектричнідля інфрачервоної області, з використанням термоелементів.
Алгоритм проведення спектрального аналізу:
1. Якісний аналіз:
· Отримання спектру зразка;
· Розшифрувати спектр за таблицями чи атласами спектрів;
· Знайти в спектрі лінії чи полюси, що характеризують атоми, молекули чи їхні структурні елементи.
2. Кількісний аналіз:
· Фотометризувати спектр, тобто визначити інтенсивність характерних ліній;
· Отримати величину концентрації, використовуючи залежність між концентрацією та інтенсивністю ліній чи смуг.
Спектральні апарати
Для точного дослідження спектрів такі прості пристосування, як вузька щілина, що обмежує світловий пучок, і призма, вже недостатні. Необхідні прилади, які дають чіткий спектр, тобто прилади, добре розділяють хвилі різної довжини і не допускають перекриття окремих ділянок спектра. Такі прилади називають спектральними апаратами. Найчастіше основною частиною спектрального апарата є призма або дифракційна сітка.
Розглянемо схему пристрою призмового спектрального апарату. Досліджуване випромінювання надходить спочатку в частину приладу, звану коліматорами. Коліматор представляє собою трубу, на одному кінці якої є ширма з вузькою щілиною, а на іншому, що збирає - лінза. Щілина знаходиться на фокусній відстані від лінзи. Тому розходячись світловий пучок, що потрапляє на лінзу з щілини, виходить з неї паралельним пучком і падає на призму. Так як різним частотах відповідають різні показники заломлення, то з призми виходять паралельні пучки, що не збігаються за напрямком. Вони падають на лінзу. На фокусній відстані цієї лінзи розташовується екран - матове скло або фотопластинки. Лінза фокусує паралельні пучки променів на екрані, і замість одного зображення щілини виходить цілий ряд зображень. Кожній частоті (вузького спектрального інтервалу) відповідає своє зображення. Всі ці зображення разом і утворюють спектр.

Описаний прилад називається спектрографом. Якщо замість другої лінзи і екрану використовується зорова труба для візуального спостереження спектрів, то прилад називається спектроскопом. Призми та інші деталі спектральних апаратів необов'язково виготовляються зі скла. Замість скла застосовуються і такі прозорі матеріали, як кварц, кам'яна сіль та ін.
Застосування спектрального аналізу.
В даний час визначені спектри всіх атомів і складені таблиці спектрів. За допомогою спектрального аналізу було відкрито багато нових елементів: рубідій, цезій та ін Елементам часто давали назви відповідно до кольору найбільш інтенсивних ліній спектра. Рубідій дає темно-червоні, рубінові лінії. Слово цезій означає «небесно-блакитний», це колір основних ліній спектру цезію. Саме за допомогою спектрального аналізу дізналися хімічний склад Сонцяі і зірок. Інші методи аналізу тут взагалі неможливі. Виявилося, що зірки складаються з тих же самих хімічних елементів, які є і на Землі. Цікаво, що гелій спочатку відкрили на Сонці, і лише потім знайшли в атмосфері Землі. Назва цього елемента нагадує про історію його відкриття: слово гелій означає в перекладі «сонячний». Завдяки порівняльній простоті і універсальності спектральний аналіз є основним методом контролю складу речовини в металургії, машинобудуванні, атомної індустрії. За допомогою спектрального аналізу визначають хімічний склад руд і мінералів. Склад складних, головним чином органічних, сумішей аналізується за їх молекулярними спектрами. Спектральний аналіз можна проводити не тільки за спектрами випускання, але і за спектрами поглинання. Саме лінії поглинання в спектрі Сонця і зірок дозволяють досліджувати хімічний склад цих небесних тіл. Яскраво світиться поверхня Сонця - фотосфера - дає неперервний спектр. Сонячна атмосфера поглинає вибірково світло від фотосфери, що призводить до появи ліній поглинання на фоні безперервного спектру фотосфери. Але й сама атмосфера Сонця випромінює світло. Під час сонячних затемнень, коли сонячний диск закрито Місяцем, відбувається звернення ліній спектра. На місці ліній поглинання в сонячному спектрі спалахують лінії випромінювання.
У астрофізиці під спектральним аналізом розуміють не тільки визначення хімічного складу зірок, газових хмар і т. д., але і знаходження по спектрах багатьох інших фізичних характеристик цих об'єктів: температури, тиску, швидкості руху, магнітної індукції.
Важливо знати, з чого складаються оточуючі нас тіла. Винайдено багато способів визначення їх складу. Але склад зірок і галактик можна дізнатися тільки за допомогою спектрального аналізу. Значну роль АСА грає в атомній техніці,виробництві чистихнапівпровідникових матеріалів,надпровідників і т. д. Методами АСА виконується більше 3/4 всіх аналізів у металургії. За допомогою квантометрів проводять оперативний (протягом 2-3 хв) контроль під час плавки в мартенівському і конвертерному виробництвах. У геології та геологічного розвідку для оцінки родовищ виробляють близько 8 млн. аналізів на рік. АСА застосовується для охорони навколишнього середовища та аналізу грунтів, у криміналістиці і медицині, геології морського дна і дослідженні складу верхніх шарів атмосфери, при поділі ізотопів і визначенні віку і складу геологічних іархеологічних об'єктів і т. д.
Висновки
Ми встановили, що метод дослідження хімічного складу різних речовин по їх лінійчатих спектрах випускання або поглинання називають спектральним аналізом. Для спектрального аналізу потрібно зовсім незначну кількість речовини.
Швидкість і чутливість зробили цей метод незамінним, як в лабораторіях, так і в астрофізиці
Отже, спектральний аналіз застосовується майже в усіх найважливіших сферах людської діяльності. Таким чином, спектральний аналіз є одним з найважливіших аспектів розвитку не тільки наукового прогресу, а й самого рівня життя людини.
Список використаної літератури:
1. А. А. Бабушкин, П. А. Бажулин и другие, Методы спектрального анализа. М., 1962;
2. Методи спектрального аналізу, М., 1962;
3. Чулановскій В. М., Введення в молекулярний спектральний аналіз, М. - Л.,1951;
4. Русанов А. К., Основи кількісного спектрального аналізу руд і мінералів. М., 1971.