 |
|
Потенциальная энергия электрона равна
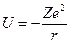 .
.
Следовательно, уравнение Шредингера имеет вид
 . (18)
. (18)
Можно показать, что уравнение (18) имеет решение, удовлетворяющее стандартным условиям, в следующих случаях: 1) при любых положительных значениях E; 2) при дискретных отрицательных значениях энергии, равных
 . (19)
. (19)
Случай  соответствует электрону, пролетающему вблизи ядра, т.е. свободному электрону. Случай
соответствует электрону, пролетающему вблизи ядра, т.е. свободному электрону. Случай  соответствует электрону, движущемуся вблизи ядра, т.е. связанному электрону. Самый нижний уровень
соответствует электрону, движущемуся вблизи ядра, т.е. связанному электрону. Самый нижний уровень  , отвечающий минимально возможной энергии, называется основным, все остальные – возбужденными. Таким образом, квантование энергии атома является следствием теории, в отличие от теории Бора, в которой квантование вводилось как постулат.
, отвечающий минимально возможной энергии, называется основным, все остальные – возбужденными. Таким образом, квантование энергии атома является следствием теории, в отличие от теории Бора, в которой квантование вводилось как постулат.
Собственные функции уравнения (18), представленные в сферической системе координат, содержат три целочисленных параметра: главное число n, орбитальное число l и магнитное число m
 .
.
Главное число n определяет энергетический уровень электрона в атоме в соответствии с формулой (19) и может принимать любые положительные целочисленные значения.
Орбитальное число l определяет орбитальный момент импульса электрона. Согласно законам квантовой механики момент импульса квантуется по правилу
 . (20)
. (20)
При заданном n орбитальное число может принимать значения
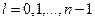 . (21)
. (21)
Магнитное число m определяет ориентацию орбитального момента в пространстве. Согласно законам квантовой механики величина проекции момента на некоторое направление z принимает дискретные значения
 ,
,
где m – магнитное квантовое число, которое при заданном l может принимать значения
 .
.
Таким образом, вектор момента импульса электрона в атоме может иметь в пространстве  возможных ориентаций.
возможных ориентаций.
Согласно (19) энергия электрона зависит только от главного квантового числа n. Каждому собственному значению энергии 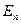 (кроме
(кроме  ) соответствует несколько собственных функций
) соответствует несколько собственных функций  , отличающихся значениями квантовых чисел l и m. Это означает, что атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях.
, отличающихся значениями квантовых чисел l и m. Это означает, что атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях.
Состояния с одинаковой энергией называются вырожденными, а число различных состояний с каким-либо значением энергии называется кратностью вырождения соответствующего энергетического уровня.
Кратность вырождения энергетических уровней легко вычисляется путем подсчета возможных значений l и m. Каждому значению квантового числа l соответствует  значений квантового числа m. Следовательно, число различных состояний, соответствующих данному n, равно
значений квантового числа m. Следовательно, число различных состояний, соответствующих данному n, равно
 . (22)
. (22)
В атомной физике применяется условное обозначение состояний электрона с различными значениями момента импульса. Электрон, находящийся в состоянии с  называется s-электроном (соответствующее состояние – s-состоянием), с
называется s-электроном (соответствующее состояние – s-состоянием), с  – p-электроном, с
– p-электроном, с  – d-электроном, с
– d-электроном, с 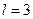 – f-электроном и далее по алфавиту. Значение главного квантового числа указывается перед условным обозначением орбитального числа l. Поскольку l всегда меньше n, возможны следующие состояния электрона:
– f-электроном и далее по алфавиту. Значение главного квантового числа указывается перед условным обозначением орбитального числа l. Поскольку l всегда меньше n, возможны следующие состояния электрона:
1s,
2s, 2p,
3s, 3p, 3d
и т.д. Схему уровней энергии удобно изображать так, как показано на рис.
Испускание и поглощение света происходит при переходах электрона с одного уровня на другой. В квантовой механике доказывается, что для орбитального квантового числа имеется правило отбора
 . (23)
. (23)
Это означает, что возможны только такие переходы, при которых l меняется на единицу. Правило обусловлено тем, что фотон обладает собственным моментом импульса (спином s). Его величина вычисляется по общему правилу (20), где вместо l следует использовать  . Данное значение определяет максимальную величину проекции спина на избранное направление. Испускание или поглощение фотона, согласно закону сохранения момента импульса, приводит к изменению момента импульса атома, согласно с правилом (23).
. Данное значение определяет максимальную величину проекции спина на избранное направление. Испускание или поглощение фотона, согласно закону сохранения момента импульса, приводит к изменению момента импульса атома, согласно с правилом (23).
На рис. показаны переходы, разрешенные правилом (23). Серии Лаймана соответствует переходам
 ;
;
серии Бальмера соответствуют переходы
 и
и  ,
,
и т.д.
Решение уравнения Шредингера для атома водорода дает, что волновая функция электрона в 1s состоянии является сферически-симметричной и имеет вид
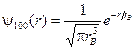 ,
,
где  есть боровский радиус. Вероятность нахождения электрона в шаровом слое радиуса r и толщиной dr равна
есть боровский радиус. Вероятность нахождения электрона в шаровом слое радиуса r и толщиной dr равна
 .
.
Подставив в формулу волновую функцию, получим
 .
.
График радиальной плотности вероятности  изображен на рис. Ее максимум приходится на
изображен на рис. Ее максимум приходится на  . Таким образом, в основном состоянии атома водорода наиболее вероятное расстояние между ядром и электроном равно боровскому радиусу.
. Таким образом, в основном состоянии атома водорода наиболее вероятное расстояние между ядром и электроном равно боровскому радиусу.
Спин электрона. Спиновое квантовое число. При классическом движении по орбите электрон обладает магнитным моментом. Причем классическое отношение магнитного момента к механическому имеет значение
 , (1)
, (1)
где  и
и  – соответственно магнитный и механический момент. К аналогичному результату приводит и квантовая механика. Так как проекция орбитального момента на некоторое направление может принимать только дискретные значения, то это же относится и к магнитному моменту. Поэтому, проекция магнитного момента на направление вектора B при заданном значении орбитального квантового числа l может принимать значения
– соответственно магнитный и механический момент. К аналогичному результату приводит и квантовая механика. Так как проекция орбитального момента на некоторое направление может принимать только дискретные значения, то это же относится и к магнитному моменту. Поэтому, проекция магнитного момента на направление вектора B при заданном значении орбитального квантового числа l может принимать значения
 ,
,
где  – так называемый магнетон Бора.
– так называемый магнетон Бора.
О. Штерн и В. Герлах в своих опытах проводили прямые измерения магнитных моментов. Они обнаружили, что узкий пучок атомов водорода, заведомо находящихся в s-состоянии, в неоднородном магнитном поле расщепляется на два пучка. В этом состоянии момент импульса, а с ним и магнитный момент электрона равен нулю. Таким образом, магнитное поле не должно оказывать влияние на движение атомов водорода, т.е. расщепления быть не должно.
Для объяснения этого и других явлений Гаудсмит и Уленбек выдвинули предположение, что электрон обладает собственным моментом импульса  , не связанным с движением электрона в пространстве. Этот собственный момент был назван спином.
, не связанным с движением электрона в пространстве. Этот собственный момент был назван спином.
Первоначально предполагалось, что спин обусловлен вращением электрона вокруг своей оси. Согласно этим представлениям для отношения магнитного и механического моментов должно выполняться соотношение (1). Экспериментально было установлено, что это отношение в действительности в два раза больше, чем для орбитальных моментов
 .
.
По этой причине, представление электрона как о вращающемся шарике оказывается несостоятельным. В квантовой механике спин электрона (и всех других микрочастиц) рассматривается как внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Величина собственного момента импульса микрочастицы определяется в квантовой механике с помощью спинового квантового числа s (для электрона  )
)
 .
.
Проекция спина на заданное направление может принимать квантованные значения, отличающиеся друг от друга на  . Для электрона
. Для электрона
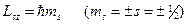 ,
,
где  – магнитное спиновое квантовое число.
– магнитное спиновое квантовое число.