 |
|
Состав и характеристика атомного ядра
Ядра атомов состоят из двух видов элементарных частиц – протонов и нейтронов. Эти частицы носят название нуклонов.
Протон (р)представляет собой ядро атома водорода. Он обладает зарядом +е и массой
mp = 938,2 Мэв. (1)
В ядерной физике принято выражать массы в единицах энергии, умножая их для этой цели на с2. Применяется также единица массы, называемая атомной единицей массы (а. е. м.).
1 а. е. м. = 1,66 10-24г = 931 Мэв.
Масса электрона, выраженная в единицах энергии, составляет
mе = 0,511 Мэв. (2)
Из сопоставления (1) и (2) следует, что Mp = 1836 mе.
Протон имеет спин, равный половине (s = ½), и собственный магнитный момент
mр = 2,79 m0 = 2,79  , (3)
, (3)
где m0 =  = 5,05 10-24 эрг/гаусс – единица магнитного момента, называемая ядерным магнетоном. Из сравнения с соответствующим выражением для электрона:
= 5,05 10-24 эрг/гаусс – единица магнитного момента, называемая ядерным магнетоном. Из сравнения с соответствующим выражением для электрона:  эрг/гаусс вытекает, что m0 в 1836 раз меньше магнетона Бора mВ. Следовательно, собственный магнитный момент протона примерно в 660 раз меньше, чем магнитный момент электрона.
эрг/гаусс вытекает, что m0 в 1836 раз меньше магнетона Бора mВ. Следовательно, собственный магнитный момент протона примерно в 660 раз меньше, чем магнитный момент электрона.
Нейтроном (n)называется не обладающая электрическим зарядом частица с массой
mn = 939,5 Мэв, (4)
очень близкой к массе протона. Разность масс нейтрона и протона mp – mn составляет 1,3 Мэв,т. е. 2,5 те.
Нейтрон обладает спином, равным половине (s = 1/2), (несмотря на отсутствие электрического заряда), собственным магнитным моментом
mр = –1,91 m0.
Знак минус указывает на то, что направления собственных механического и магнитного моментов противоположны.
В свободном состоянии нейтрон нестабилен (радиоактивен) – он самопроизвольно распадается, превращаясь в протон и испуская электрон (е-)и еще одну частицу, называемую антинейтрино (  ). Период полураспада равен ~ 12 мин.Схему распада можно записать следующим образом:
). Период полураспада равен ~ 12 мин.Схему распада можно записать следующим образом:
 . (5)
. (5)
Масса покоя антинейтрино равна нулю. Масса нейтрона, как мы видели, больше массы протона на 2,5 те, следовательно, масса нейтрона превышает суммарную массу частиц, фигурирующих в правой части уравнения (5), на 1,5 те, т. е. на 0,77 Мэв.Эта энергия выделяется при распаде нейтрона в виде кинетической энергии образующихся частиц.
Характеристика атомного ядра. Количество протонов Z, входящих в состав ядра, определяет его заряд, который равен + Zе.Число Z называется атомным номером (оно определяет порядковый номер химического элемента в периодической таблице Менделеева) или зарядовым числом ядра.
Число нуклонов А (т. е. суммарное число протонов и нейтронов) в ядре называется массовым числом ядра. Число нейтронов в ядре равно N = A – Z.
Для обозначения ядер применяется символ

где под X подразумевается химический символ данного элемента. Справа вверху ставится массовое число, слева внизу – атомный номер (последний значок часто опускают, т. к. оно обычно определяется символом Х).
Большинство химических элементов имеет по нескольку разновидностей – изотопов, отличающихся значениями массового числа А. Так, например, водород имеет три изотопа:  – обычный водород, или протий (Z = l, N = 0),
– обычный водород, или протий (Z = l, N = 0),  – тяжелый водород, или дейтерий (D: Z =1, N = 1),
– тяжелый водород, или дейтерий (D: Z =1, N = 1),  – тритий (Т: Z = 1,N = 2).
– тритий (Т: Z = 1,N = 2).
У кислорода имеется три стабильных изотопа: 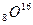 ,
,  , и
, и  . У олова – десять изотопов. Изотопы представляют собой ядра с одинаковым числом протонов Z. Ядра с одинаковым массовым числом А называются изобарами. В качестве примера можно привести
. У олова – десять изотопов. Изотопы представляют собой ядра с одинаковым числом протонов Z. Ядра с одинаковым массовым числом А называются изобарами. В качестве примера можно привести  и
и 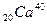 . Ядра с одинаковым числом нейтронов N = А – Z носят название изотонов (
. Ядра с одинаковым числом нейтронов N = А – Z носят название изотонов ( 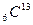 и
и 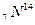 ). Наконец, существуют радиоактивные ядра с одинаковыми Z и А, отличающиеся периодом полураспада. Они называются изомерами. Например, имеется два изомера ядра
). Наконец, существуют радиоактивные ядра с одинаковыми Z и А, отличающиеся периодом полураспада. Они называются изомерами. Например, имеется два изомера ядра  : у одного из них период полураспада равен 18 мин, удругого – 4,4 часа.
: у одного из них период полураспада равен 18 мин, удругого – 4,4 часа.
Радиус ядра довольно точно определяется формулой:
 см
см  ферми (6)
ферми (6)
(ферми – название применяемой в ядерной физике единицы длины, равной 10-13 см). Из соотношения (6) следует, что объем ядра пропорционален числу нуклонов в ядре.
В настоящее время известно около 1500 ядер, различающихся Z, либо А,либо и тем и другим. Около ¼ этих ядер устойчивы, остальные радиоактивны. Многие ядра были получены искусственным путем с помощью ядерных реакций.
В природе встречаются элементы с Z от 1 до 92, исключая технеций (Тс, Z = 43) и прометий (Pm, Z = 61). Плутоний (Рu, Z = 94) после получения его искусственным путем был обнаружен в ничтожных количествах в природном минерале – смоляной обманке. Остальные трансурановые (т. е. заурановые) элементы (с Z от 93 до 104) были получены только искусственным путем посредством различных ядерных реакций.
Для устойчивых ядер характерно определенное отношение числа нейтронов N к числу протонов Z. У легкихядер это отношение близко к единице. По мере увеличения числа нуклонов в ядре N/Z растет, достигая для урана значения 1,6 (см. рис. 1). Точки на рисунке соответствуют отдельным стабильным ядрам).

| Рис. 1. |
Спин ядра. Спины нуклонов складываются в результирующий спин ядра. Спин нуклона равен ½, поэтому согласно квантовым законам сложения моментов квантовое число спина ядра I будет полуцелым при нечетном числе нуклонов А и целым или нулем при четном А. Спины ядер I не превышают нескольких единиц. Это указывает на то, что спины большинства нуклонов в ядре взаимно компенсируют друг друга, располагаясь антипараллельно. У всех четно-четных ядер (т. е. ядер с четным числом протонов и четным числом нейтронов) спин равен нулю.
Результирующий момент ядра МI складывается с моментом электронной оболочки МJ в полный момент импульса атома МF, который определяется квантовым числом F.
С механическими моментами связаны магнитные моменты. Взаимодействие магнитных моментов электронов ядра приводит к тому, что состояния атома соответствующие различным взаимным ориентациям МI и МJ (т. е. различным F)имеют немного отличающуюся энергию. Взаимодействием моментов mL и mS обусловливается тонкая структура спектров. Взаимодействием mI и mJ определяется сверхтонкая структура атомных спектров. Расщепление спектральных линий, соответствующее сверхтонкой структуре, настолько мало (порядка нескольких сотых ангстрема), что может наблюдаться лишь с помощью приборов самой высокой разрешающей силы.